FDA批准MEK抑制剂mirdametinib用于1型神经纤维瘤儿童患者
2025-02-15 药械新前沿 药械新前沿 发表于加利福尼亚
作为首个获批可同时用于治疗成人和儿童NF1-PN的药物,mirdametinib有望成为儿童NF1-PN患者的 “best-in-class” 疗法。Mirdametinib 此前还获得了孤儿药、快速
2月11日,美国FDA宣布批准MEK抑制剂 Gomekli(mirdametinib)上市,用于治疗手术无法完全切除的丛状神经纤维瘤成人和不低于两岁的儿童1型神经纤维瘤患者(NF1-PN)。作为首个获批可同时用于治疗成人和儿童NF1-PN的药物,mirdametinib有望成为儿童NF1-PN患者的 “best-in-class” 疗法。Mirdametinib 此前还获得了孤儿药、快速通道和罕见儿科疾病指定。
NF1是一种遗传性疾病,患者一生中约有30%至50%的风险发展为丛状神经纤维瘤,这种肿瘤沿着外周神经鞘以浸润性方式生长,可能导致严重容貌畸形、疼痛和功能障碍。丛状神经纤维瘤还可能转变为恶性外周神经鞘瘤,这是一种侵袭性且可能致命的疾病。由于丛状神经纤维瘤沿神经浸润性生长,其外科切除十分具有挑战性,高达约85%的丛状神经纤维瘤被认为无法完全切除。

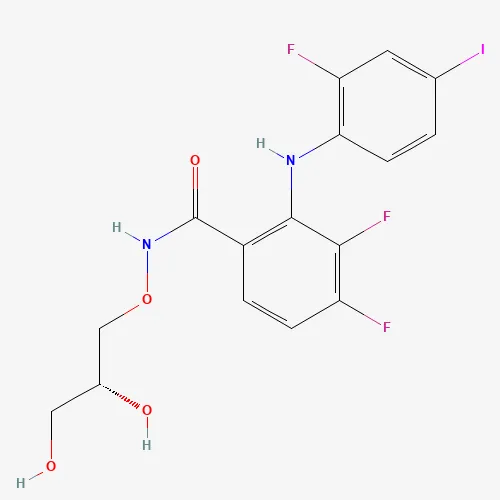
Mirdametinib分子结构
FDA 批准 GOMEKLI 是基于 2b 期 ReNeu 试验的结果,该试验招募了 114 名年龄 ≥ 2 岁的 NF1-PN 患者(58 名成人和 56 名儿科患者)。
GOMEKLI 达到了经盲法独立中央审查评估的确认客观缓解率 (ORR) 的主要终点,成人 ORR 为 41%(N= 24/ 58),儿童 ORR 为 52%(N=29/56)。肿瘤体积减少幅度大且持久;成人目标 PN 体积的最佳百分比变化中位数为 -41%(范围:-90% 至 13%),儿童为 -42%(范围:-91% 至 48%)。88% 的成人和 90% 的儿童确认有缓解,缓解持续时间至少为 12 个月,50% 和 48% 的儿童确认有缓解,缓解持续时间至少为 24 个月。 通过多种患者报告结果工具进行评估,两组患者的疼痛和生活质量也均经历了早期和持续的显著改善。
GOMEKLI 表现出可控的安全性和耐受性。接受 GOMEKLI 治疗的成人中报告的最常见不良事件 (>25%) 是皮疹、腹泻、恶心、肌肉骨骼疼痛、呕吐和疲劳。
此外,在确认获得缓解的患者中,88%的成人和90%的儿童患者的缓解持续时间至少为12个月,而50%的成人患者和48%的儿童患者的缓解持续时间至少为24个月。
Mirdametinib显示出可控的安全性和耐受性。在接受治疗的成人中,发生率超过25%的最常见不良事件包括皮疹、腹泻、恶心、肌肉骨骼疼痛、呕吐和疲劳。在儿童患者中,发生率超过25%的最常见不良事件为皮疹、腹泻、肌肉骨骼疼痛、腹痛、呕吐、头痛、甲沟炎、左心室功能障碍和恶心。
Mirdametinib是一种口服别构小分子MEK抑制剂,靶向MEK1和MEK2。美国FDA和欧盟委员会均授予mirdametinib治疗NF1的孤儿药资格。此外,FDA还授予了该药物快速通道资格,用于治疗2岁及以上的NF1-PN患者,它的新药申请也曾获得FDA授予的优先审评资格。
参考资料:
[1] SpringWorks Therapeutics Announces FDA Approval of GOMEKLI (mirdametinib) for the Treatment of Adult and Pediatric Patients with NF1-PN. Retrieved February 11, 2025, from https://www.globenewswire.com/news-release/2025/02/11/3024643/0/en/SpringWorks-Therapeutics-Announces-FDA-Approval-of-GOMEKLI-mirdametinib-for-the-Treatment-of-Adult-and-Pediatric-Patients-with-NF1-PN.html
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#1型神经纤维瘤# #神经纤维瘤# #mirdametinib#
27