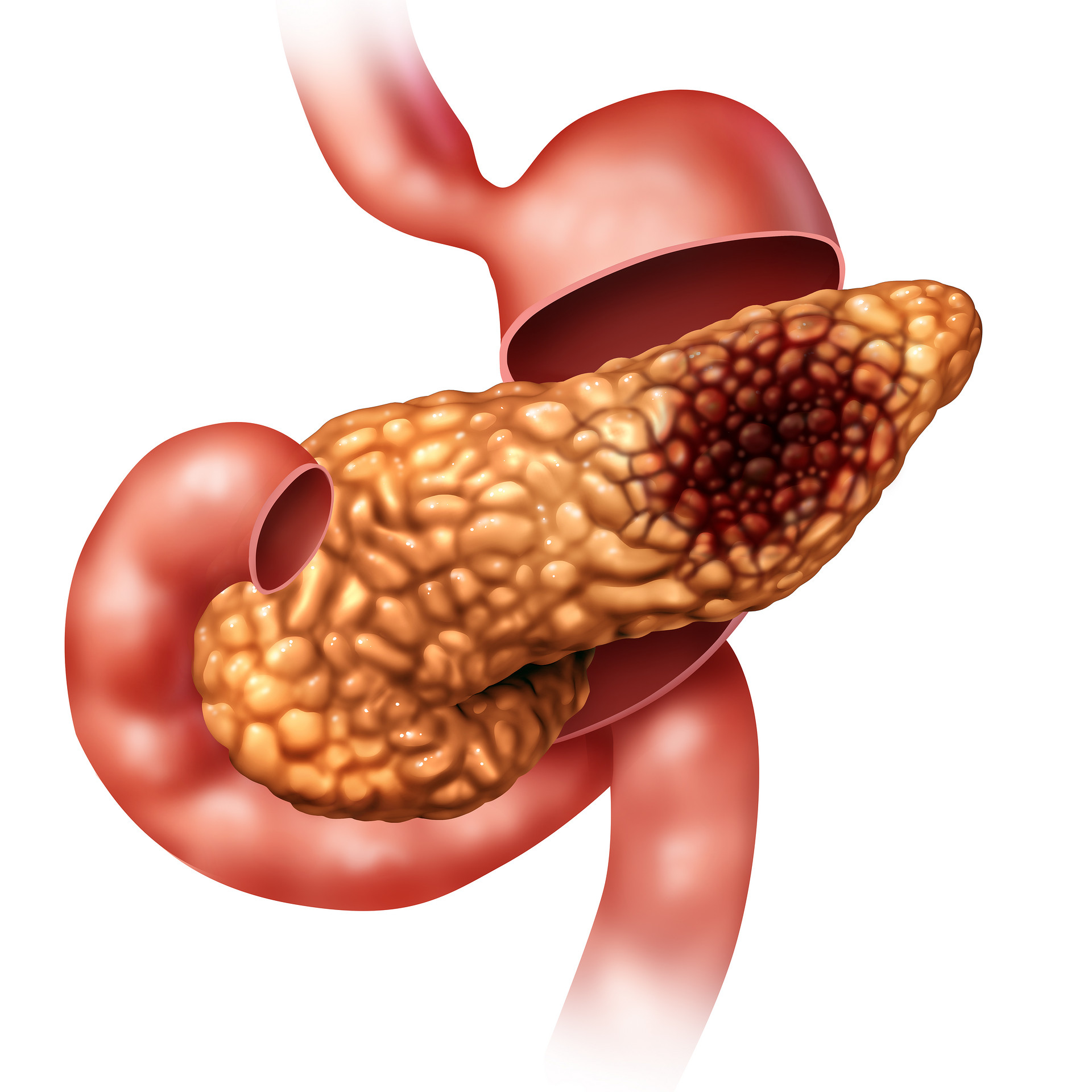
胰腺癌,素有“癌中之王”之称,其高致死率令人望而生畏。未经治疗的患者生存期仅为3-5个月,即便接受手术治疗,平均生存时间亦难超越10-20个月 (1-4)。如此严峻的预后,归因于胰腺癌的隐匿性,使其在确诊时往往已进入晚期,并伴有远处转移。此外,胰腺癌的高度侵袭性进一步限制了手术的治愈性 (5)。 流行病学研究表明,吸烟是胰腺癌最主要的风险因素,使其患病风险较不吸烟者增加2-3倍 (6-7)。此外,慢性胰腺炎、酗酒等因素也被认为与胰腺癌的发生相关 (8)。病理学上,绝大多数胰腺癌为导管腺癌,其主要发生于胰头部位。 随着细胞毒性化疗的广泛应用,胰腺癌患者的五年生存率已从2000年的5.26%提升至约10% (9-11)。二代测序技术与分子病理学的进一步发展,使精准医学在胰腺癌的治疗中成为可能,病人可以选择对肿瘤测序寻找靶向治疗的位点,进行生殖突变测序来为家人提供遗传学咨询,也可进行全外显子测序;这些测序技术的发展为胰腺癌病人提供了更具针对性的个体化方案。本文将聚焦胰腺癌的靶向治疗进展,并探讨精准医学时代下胰腺癌的治疗前沿。 01 胰腺癌的分子病理特征 胰腺癌的基因突变可为遗传突变或者体细胞突变。其中,体细胞突变在肿瘤进展中尤其重要,最常见的体细胞突变基因包括KRAS、TP53、SMAD4、CDKN2A(表1)。 · KRAS 突变率>90%,使得RAS信号通路持续激活,促进肿瘤增殖及进一步免疫逃逸。 · TP53 在大约75% 胰腺癌患者中发生功能丧失突变,双链突变的失活使癌症细胞失去抑制性生长。 · SMAD4 和 CDKN2A 突变在肿瘤细胞中广泛存在,主要影响TGF-β生长信号通路,促进肿瘤进展。 · BRCA2、ATM、PALB2 等 DNA 修复基因突变在部分患者中出现,使其对 PARP 抑制剂及铂类化疗更敏感。 除了这些常见的突变之外,其他基因组改变,如表观遗传的调控(例如CDKN2A的启动子甲基化),也在胰腺癌的发展中发挥作用。 表1:胰腺癌的常见基因突变。 02 胰腺癌的靶向治疗进展 靶向治疗的核心在于基于肿瘤的基因特征,选择最优治疗策略。目前,美国FDA 已批准数种针对胰腺癌的靶向药物(表2)。 表1:FDA批准的靶向药物。 1. BRCA1/2 或 PALB2 突变患者:PARP 抑制剂疗法 · 铂类化疗(顺铂、奥沙利铂)作为首选方案,可显著提高生存期,部分患者反应率可达 50-80%,中位总体生存期能够达到约 22 个月,明显优于无此类突变的患者(12)。 · 奥拉帕利(Olaparib)作为 PARP 抑制剂,通过“合成致死”机制,进一步削弱 BRCA 突变肿瘤的DNA修复能力,使癌细胞更易凋亡。在一项Ⅲ期临床试验中,奥拉帕利可显著改善无进展生存期,但与安慰剂相比并未明显延长总体生存率(13)。 2. MSI-H 或 dMMR 相关胰腺癌:免疫检查点抑制剂 · 微卫星不稳定性高(MSI-H)及错配修复缺陷(dMMR)在胰腺癌中的发生率低于 2%,但这些患者对PD-1 抑制剂(如帕姆单抗 Keytruda)高度敏感(14)。 · 免疫检查点抑制剂通过恢复 T 细胞活性,使免疫系统可有效识别并攻击肿瘤。 3. NTRK 基因融合:酪氨酸激酶抑制剂(TKI) · 拉罗替尼(Larotrectinib)和恩曲替尼(Entrectinib)可有效抑制 NTRK 基因融合引起的肿瘤信号异常。 · 尽管 NTRK 突变仅见于 <1% 胰腺癌患者,但 TKI 治疗可显著提高治疗反应率。 4. RET 基因融合:RET 抑制剂 · RET 基因融合可导致 RET 酪氨酸激酶持续激活,促进癌细胞生长。 · 塞尔帕替尼(Selpercatinib)在 LIBRETTO-001 临床试验中展现出 >50% 客观缓解率(ORR),成为该类胰腺癌的首选治疗方案(15)。 5. NRG1 基因融合:HER3 靶向治疗 · NRG1 基因融合发生率约 3%,导致 HER2-HER3 信号通路异常激活。 · Zenocutuzumab 作为双特异性抗体,可阻断 NRG1-HER3 结合,展现 40% 的客观缓解率(ORR)(16)。 6. 生存率的研究 · 最近一项针对晚期胰腺癌患者的研究进一步验证了精准医学靶向治疗的临床价值。在 18 例接受基因组驱动靶向治疗的患者中,基因匹配评分(genomic matching score, GMS)≥50% 的患者展现出显著的生存率提升。该研究入组病人的中位总生存期(OS)达6.8个月,无进展生存期(PFS)为3.9个月,远超 GMS 评分较低(<50%)患者的3.3个月 OS 和1.8个月 PFS (17)。 03 结论与展望 分子病理学的飞速发展,使精准医学得以在胰腺癌治疗中发挥重要作用。从传统细胞毒性化疗向靶向治疗与免疫治疗的转变,为患者带来了前所未有的希望。 当前,针对 BRCA1/2、PALB2、MSI-H、NTRK、RET 和 NRG1 等分子特征的个性化治疗方案正在不断完善,并有望成为未来的主流治疗策略。然而,胰腺癌的基因异质性仍然是治疗挑战之一,因此,未来仍需加强多组学分析,并开发新一代靶向药物,以进一步提高患者的生存率。持续推进大规模临床试验,优化精准医疗手段,将成为胰腺癌治疗领域的关键突破方向。 *本文(包括图片)均为作者投稿, 仅供行业交流学习用,不作为医疗诊断依据。 参考文献 1. Conlon KC, Klimstra DS, Brennan MF. Long-term survival after curative resection for pancreatic ductal adenocarcinoma. Clinicopathologic analysis of 5-year survivors. Ann Surg. 1996 Mar;223(3):273-9. doi: 10.1097/00000658-199603000-00007. PMID: 8604907; PMCID: PMC1235115. 2. Neoptolemos JP, Stocken DD, Dunn JA, Almond J, Beger HG, Pederzoli P, Bassi C, Dervenis C, Fernandez-Cruz L, Lacaine F, Buckels J, Deakin M, Adab FA, Sutton R, Imrie C, Ihse I, Tihanyi T, Olah A, Pedrazzoli S, Spooner D, Kerr DJ, Friess H, Büchler MW; European Study Group for Pancreatic Cancer. Influence of resection margins on survival for patients with pancreatic cancer treated by adjuvant chemoradiation and/or chemotherapy in the ESPAC-1 randomized controlled trial. Ann Surg. 2001 Dec;234(6):758-68. doi: 10.1097/00000658-200112000-00007. PMID: 11729382; PMCID: PMC1422135. 3. Kuhlmann KF, de Castro SM, Wesseling JG, ten Kate FJ, Offerhaus GJ, Busch OR, van Gulik TM, Obertop H, Gouma DJ. Surgical treatment of pancreatic adenocarcinoma; actual survival and prognostic factors in 343 patients. Eur J Cancer. 2004 Mar;40(4):549-58. doi: 10.1016/j.ejca.2003.10.026. PMID: 14962722. 4. Matsuno S, Egawa S, Fukuyama S, Motoi F, Sunamura M, Isaji S, Imaizumi T, Okada S, Kato H, Suda K, Nakao A, Hiraoka T, Hosotani R, Takeda K. Pancreatic Cancer Registry in Japan: 20 years of experience. Pancreas. 2004 Apr;28(3):219-30. doi: 10.1097/00006676-200404000-00002. PMID: 15084961. 5. Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2021. CA Cancer J Clin. 2021;71(1):7– 33. doi:10.3322/caac.21654 [PubMed: 33433946] 6. Conroy T, Desseigne F, Ychou M, et al. ; Groupe Tumeurs Digestives of Unicancer; PRODIGE Intergroup. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med. 2011; 364(19):1817–1825. doi:10.1056/NEJMoa1011923 [PubMed: 21561347] 7. Iodice S, Gandini S, Maisonneuve P, Lowenfels AB. Tobacco and the risk of pancreatic cancer: a review and meta-analysis. Langenbecks Arch Surg. 2008 Jul;393(4):535-45. doi: 10.1007/s00423-007-0266-2. Epub 2008 Jan 12. PMID: 18193270. 8. Zhao Z, Liu W. Pancreatic Cancer: A Review of Risk Factors, Diagnosis, and Treatment. Technol Cancer Res Treat. 2020 Jan-Dec;19:1533033820962117. doi: 10.1177/1533033820962117. PMID: 33357065; PMCID: PMC7768873. 9. Lynch SM, Vrieling A, Lubin JH, Kraft P, Mendelsohn JB, Hartge P, Canzian F, Steplowski E, Arslan AA, Gross M, Helzlsouer K, Jacobs EJ, LaCroix A, Petersen G, Zheng W, Albanes D, Amundadottir L, Bingham SA, Boffetta P, Boutron-Ruault MC, Chanock SJ, Clipp S, Hoover RN, Jacobs K, Johnson KC, Kooperberg C, Luo J, Messina C, Palli D, Patel AV, Riboli E, Shu XO, Rodriguez Suarez L, Thomas G, Tjønneland A, Tobias GS, Tong E, Trichopoulos D, Virtamo J, Ye W, Yu K, Zeleniuch-Jacquette A, Bueno-de-Mesquita HB, Stolzenberg-Solomon RZ. Cigarette smoking and pancreatic cancer: a pooled analysis from the pancreatic cancer cohort consortium. Am J Epidemiol. 2009 Aug 15;170(4):403-13. doi: 10.1093/aje/kwp134. Epub 2009 Jun 26. PMID: 19561064; PMCID: PMC2733861. 10. Von Hoff DD, Ervin T, Arena FP, et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med. 2013;369(18):1691–1703. doi:10.1056/NEJMoa1304369 [PubMed: 24131140] 11. Conroy T, Hammel P, Hebbar M, et al. ; Canadian Cancer Trials Group and the Unicancer-GI– PRODIGE Group. FOLFIRINOX or gemcitabine as adjuvant therapy for pancreatic cancer. N Engl J Med. 2018; 379(25):2395–2406. doi:10.1056/NEJMoa1809775 [PubMed: 30575490] 12. Kindler HL, Hammel P, Reni M, Van Cutsem E, Macarulla T, Hall MJ, Park JO, Hochhauser D, Arnold D, Oh DY, Reinacher-Schick A, Tortora G, Algül H, O'Reilly EM, Bordia S, McGuinness D, Cui K, Locker GY, Golan T. Overall Survival Results From the POLO Trial: A Phase III Study of Active Maintenance Olaparib Versus Placebo for Germline BRCA-Mutated Metastatic Pancreatic Cancer. J Clin Oncol. 2022 Dec 1;40(34):3929-3939. doi: 10.1200/JCO.21.01604. Epub 2022 Jul 14. Erratum in: J Clin Oncol. 2024 Jun 10;42(17):2112. doi: 10.1200/JCO.24.00821. PMID: 35834777; 13. Golan T, Hammel P, Reni M, Van Cutsem E, Macarulla T, Hall MJ, Park JO, Hochhauser D, Arnold D, Oh DY, Reinacher-Schick A, Tortora G, Algül H, O'Reilly EM, McGuinness D, Cui KY, Schlienger K, Locker GY, Kindler HL. Maintenance Olaparib for Germline BRCA-Mutated Metastatic Pancreatic Cancer. N Engl J Med. 2019 Jul 25;381(4):317-327. doi: 10.1056/NEJMoa1903387. Epub 2019 Jun 2. PMID: 31157963; PMCID: PMC6810605. 14. Middha S, Zhang L, Nafa K, Jayakumaran G, Wong D, Kim HR, Sadowska J, Berger MF, Delair DF, Shia J, Stadler Z, Klimstra DS, Ladanyi M, Zehir A, Hechtman JF. Reliable Pan-Cancer Microsatellite Instability Assessment by Using Targeted Next-Generation Sequencing Data. JCO Precis Oncol. 2017;2017:PO.17.00084. doi: 10.1200/PO.17.00084. Epub 2017 Oct 3. PMID: 30211344; PMCID: PMC6130812. 15. Subbiah V, Wolf J, Konda B, Kang H, Spira A, Weiss J, Takeda M, Ohe Y, Khan S, Ohashi K, Soldatenkova V, Szymczak S, Sullivan L, Wright J, Drilon A. Tumour-agnostic efficacy and safety of selpercatinib in patients with RET fusion-positive solid tumours other than lung or thyroid tumours (LIBRETTO-001): a phase 1/2, open-label, basket trial. Lancet Oncol. 2022 Oct;23(10):1261-1273. doi: 10.1016/S1470-2045(22)00541-1. Epub 2022 Sep 12. PMID: 36108661; PMCID: PMC11702314. 16. Schram AM, Odintsov I, Espinosa-Cotton M, Khodos I, Sisso WJ, Mattar MS, Lui AJW, Vojnic M, Shameem SH, Chauhan T, Torrisi J, Ford J, O'Connor MN, Geuijen CAW, Schackmann RCJ, Lammerts van Bueren JJ, Wasserman E, de Stanchina E, O'Reilly EM, Ladanyi M, Drilon A, Somwar R. Zenocutuzumab, a HER2xHER3 Bispecific Antibody, Is Effective Therapy for Tumors Driven by NRG1 Gene Rearrangements. Cancer Discov. 2022 May 2;12(5):1233-1247. doi: 10.1158/2159-8290.CD-21-1119. PMID: 35135829; PMCID: PMC9394398. 17. 8.Shaya J., Kato S., Adashek J.J., Patel H., Fanta P.T., Botta G.P., Sicklick J.K., Kurzrock R. Personalized matched targeted therapy in advanced pancreatic cancer: A pilot cohort analysis. NPJ Genom. Med. 2023;8:1. doi: 10.1038/s41525-022-00346-5

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#胰腺癌# #精准医学#
5