JEM:肠道淋巴血管根据引流区域功能差异化,蛔虫感染改变其形态与功能
20小时前 MedSci原创 MedSci原创 发表于威斯康星
淋巴内皮细胞的转录组分析揭示了沿胃肠道的梯度性基因表达及感染引发的免疫和血管生成反应,提示淋巴血管的适应性与可塑性。
Highlight
- 肠道淋巴血管具有区域特异性功能与转录差异,十二指肠的淋巴毛细血管(乳糜管)特别优化用于膳食脂质吸收。
- 十二指肠特异性蛔虫感染导致乳糜管结构和通透性改变,削弱脂质转运功能,解释了寄生虫感染后抗体重增加的现象。
- 淋巴内皮细胞的转录组分析揭示了沿胃肠道的梯度性基因表达及感染引发的免疫和血管生成反应,提示淋巴血管的适应性与可塑性。
研究背景与核心内容
淋巴系统作为体液回收与免疫细胞运输的关键网络,其组织功能在不同脏器中存在差异。肠道特别是小肠中的乳糜管不仅回收组织间液,还承担脂质吸收的独特功能。当前尚不明确淋巴血管是否针对引流组织功能适应性分化,以及外界侵扰如寄生虫感染如何影响淋巴系统的结构与功能。美国芝加哥大学等团队最新研究发表在《The Journal of Experimental Medicine》,通过结构学、功能学以及RNA测序分析揭示了沿肠道不同段落的淋巴血管特性及蛔虫感染下的动态变化,深化了对肠道淋巴系统在稳态及炎症状态下的理解。
研究背景与现状
淋巴系统主要由初始淋巴毛细血管引流组织间液,再经由阀膜及周围平滑肌驱动,单向输送液体和免疫细胞至引流淋巴结,最终回流血液。淋巴血管功能失调与多种疾病相关,包括淋巴水肿、肥胖、炎症性肠病等,但组织特异性淋巴内皮细胞(LECs)功能及病理变化机制尚欠详尽阐明。已有影像及转录组研究证实淋巴血管根据所处组织特性存在形态和免疫功能的差异,尤其肠道乳糜管作为脂质(尤其膳食长链脂肪酸)吸收的重要通路,但其功能适应性特点与外界病菌感染下的变化机制未被系统研究。
主要研究结果
1. 小肠淋巴系统存在区域特异性结构与吸收梯度
研究团队对小肠不同段落(十二指肠、空肠和回肠)乳糜管结构及功能特征进行定量分析。发现十二指肠乳糜管具有最不连续(“button-like”)的VE-cadherin细胞连接,通透性最高,适应快速脂质吸收。随肠道远端,乳糜管连接趋向连续“拉链样”(“zipper-like”),通透性降低。
利用VEGFR-3缺失小鼠模型(Vegfr3 ΔProx1),证实十二指肠乳糜管“拉链化”连接增多,导致脂类(橄榄油灌胃后)吸收显著受阻,淋巴结脂质含量降低,血浆甘油三酯水平下降;反之通过VEGFR-2阻断增强空肠乳糜管通透性,局部淋巴结脂质积累增加,但对全身血浆影响不大,表明十二指肠是主要脂质吸收部位。
此外,短期或长期减少膳食脂肪摄入均未改变乳糜管布局,提示该结构在成年小鼠中相对稳定。
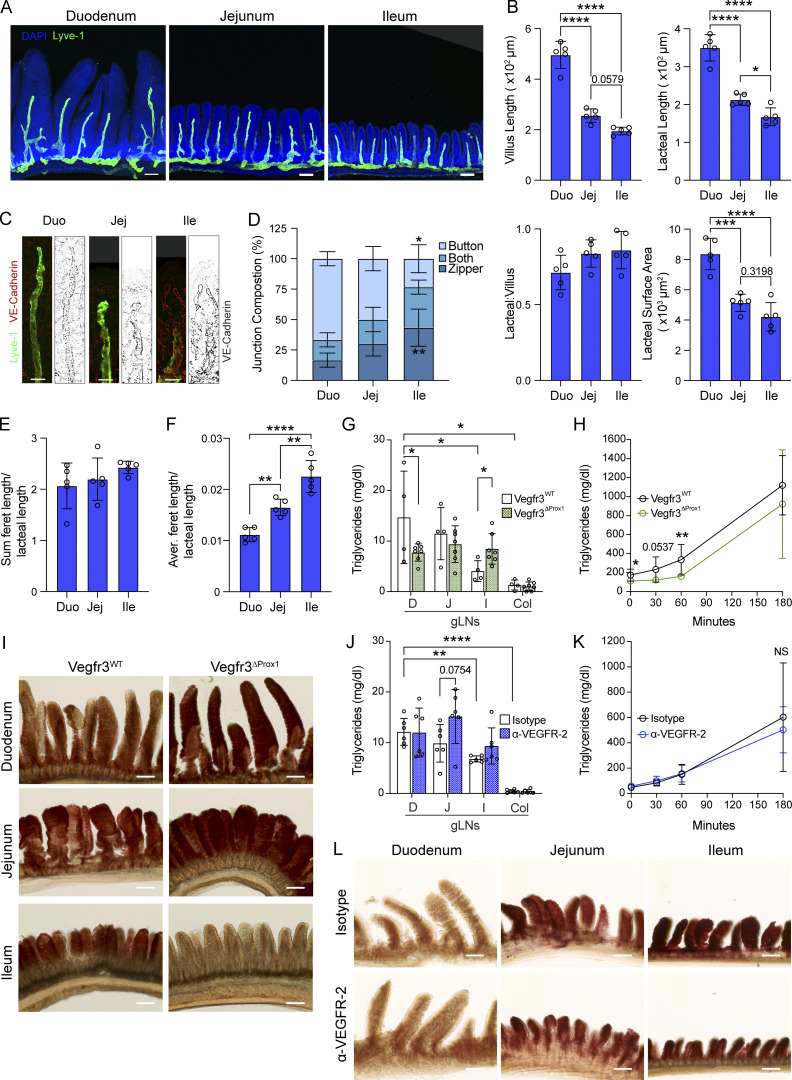
图1. 肠道不同区域淋巴系统形态与功能差异,十二指肠乳糜管结构最适合脂质吸收。
2. 蛔虫感染改变十二指肠乳糜管结构,减弱脂质吸收功能
感染典型十二指肠特异性蛔虫(Strongyloides venezuelensis、Nippostrongylus brasiliensis、Heligmosomoides polygyrus)均导致乳糜管变长且淋巴内皮连接向“拉链状”连接转变,通透性降低。《油红O》染色及油脂灌胃实验显示脂质堆积于肠上皮细胞,淋巴结及血浆中甘油三酯水平显著下降,表明膳食脂质被滞留。对应的体重增加在高脂饮食(HFD)条件下受感染者明显减弱,提示淋巴吸收受限致减肥现象。
免疫荧光显示感染增加乳糜管内Prox1+及Ki67+细胞数量,反映淋巴管生成活跃,形态改变主要限于感染部位十二指肠,肠道其它部分影响较小。
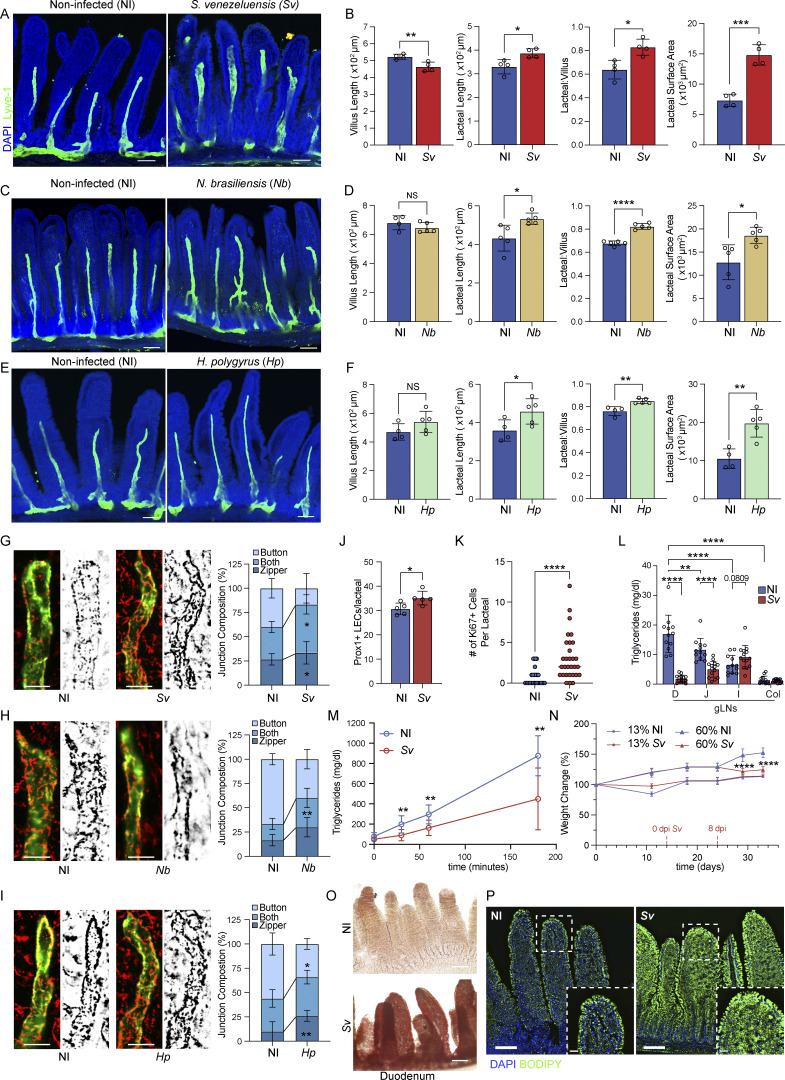
图2. 蛔虫感染显著改变十二指肠乳糜管形态及脂质吸收功能。
3. 淋巴内皮细胞转录组在不同肠段具有差异,蛔虫感染诱发转录重编程
通过分离不同肠段的小鼠淋巴内皮细胞(LECs)进行转录组测序发现,十二指肠LECs呈现与远端回肠截然不同的基因表达谱,十二指肠LECs富集于细胞结合、脂质代谢及免疫相关通路,而回肠LECs则偏向细胞周期和增殖活跃基因。蛔虫感染引发十二指肠LECs转录模式部分向回肠型靠拢,表现为增殖细胞程序增强,脂质代谢降低,暗示感染诱导淋巴血管再生并重塑功能特性。
分离血管内皮细胞(BECs)作为对比,感染后LECs表达变化更为显著,提示肠道淋巴血管对感染反应具有较强专一性。
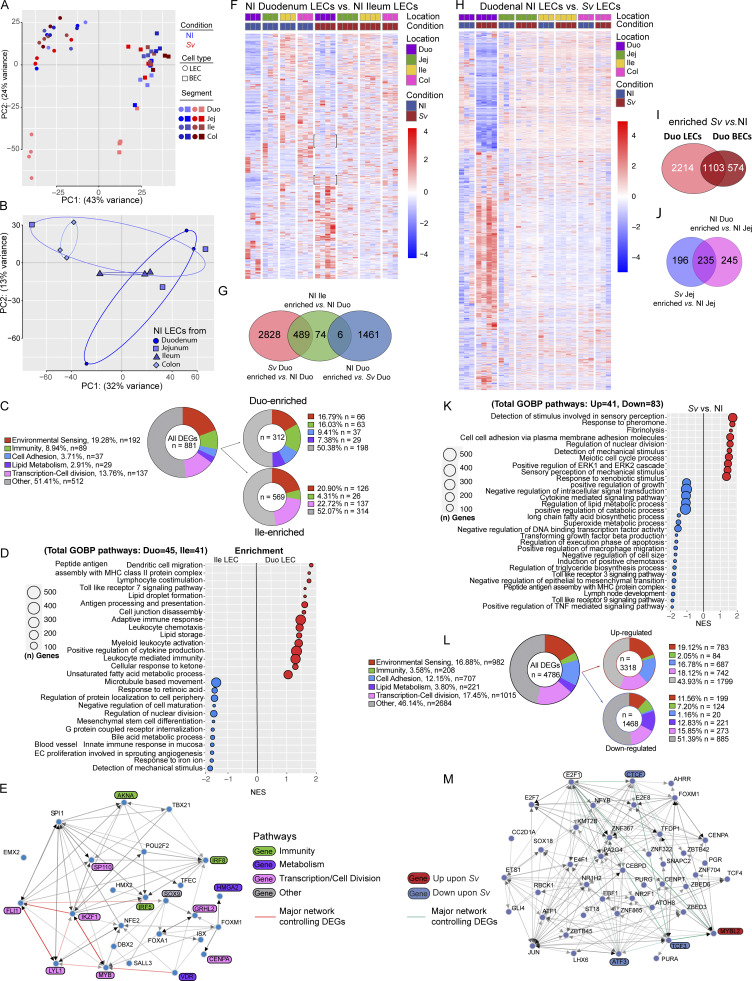
图3. 肠段LEC转录组存在功能差异,蛔虫诱导十二指肠LEC增殖及功能重编程。
4. 局部肠粘膜环境转录特征与LECs功能相匹配,蛔虫感染选择性影响十二指肠粘膜
粘膜层转录组分析显示小肠不同部位存在独特转录特征,十二指肠富集脂质代谢及血管发育通路。蛔虫感染导致的十二指肠粘膜基因表达变化包括免疫应答增强和脂质代谢下降,与LECs转录变化高度一致,提示淋巴内皮细胞对其微环境的敏感适应。
感染后十二指肠免疫细胞因子及修复相关基因表达随感染进程动态变化,淋巴管形态变化与免疫反应紧密同步。
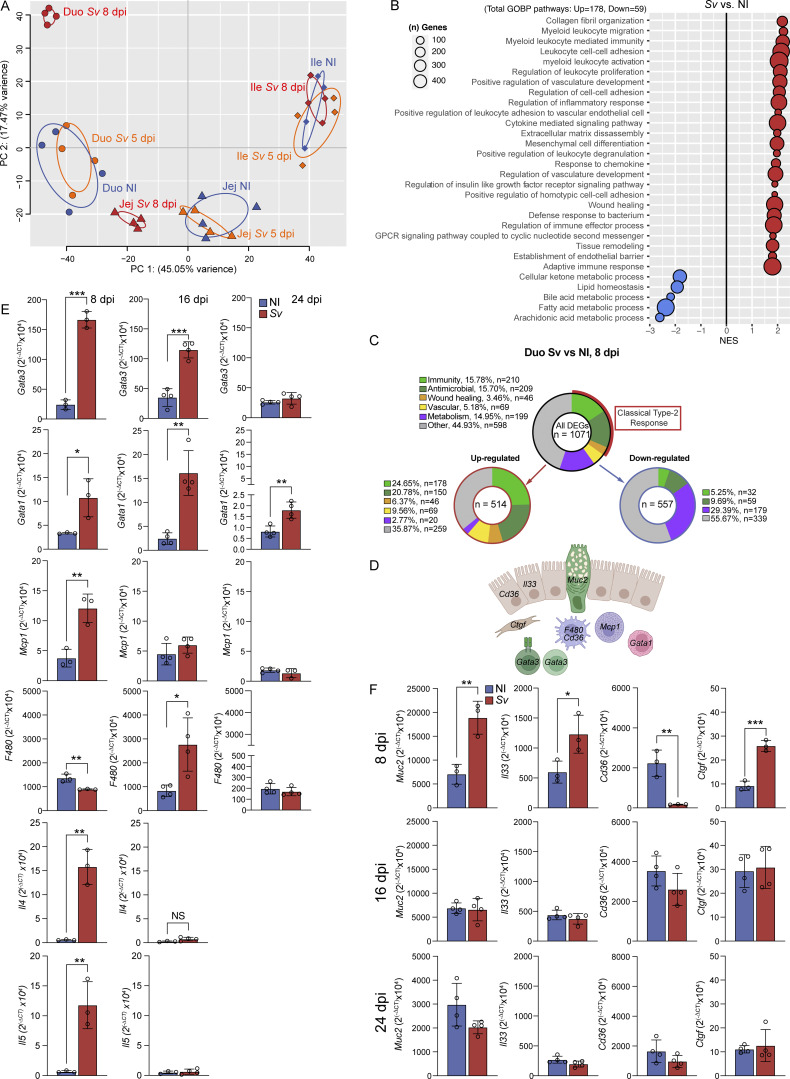
图4. 蛔虫感染使十二指肠粘膜免疫与代谢基因表达显著改变。
5. 免疫炎症驱动淋巴管新生与连接“拉链状”增加,IL-4单独刺激不足以重塑淋巴结构
免疫缺陷小鼠实验显示,先天免疫系统存在时,蛔虫感染仍能诱发乳糜管增生,但缺乏先天淋巴细胞功能(NSG及Rag1-Il2rg双敲鼠)时,此现象不显著。IL-4重组蛋白短期注射并未复制感染引起的乳糜管通透性变化,提示Th2细胞及IL-4非直接作用于LECs,炎症介导的复杂信号更为关键。
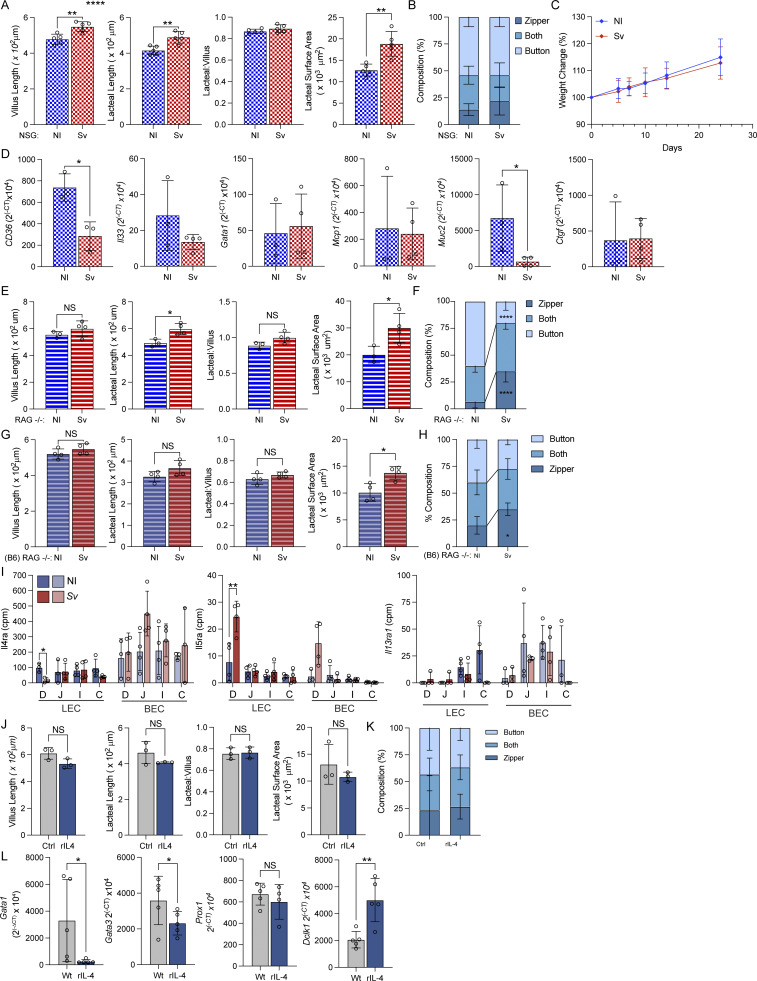
图5. 先天免疫及炎症信号是乳糜管感染重塑的关键,IL-4单独作用不足。
6. VEGF家族分子表达梯度与淋巴管形态相关,感染后VEGF-C蛋白上调促进淋巴管新生
VEGF受体与配体表达在小肠呈梯度分布,VEGFR-2及其辅受体Nrp1在近端逐渐下调,淋巴内皮细胞维持恒定表达。VEGF-A蛋白梯度与乳糜管连接通透性梯度相符。蛔虫感染显著降低VEGF-A并上调VEGF-C蛋白,提示VEGF-C介导的淋巴管生成调控感染期间乳糜管结构及功能折返。
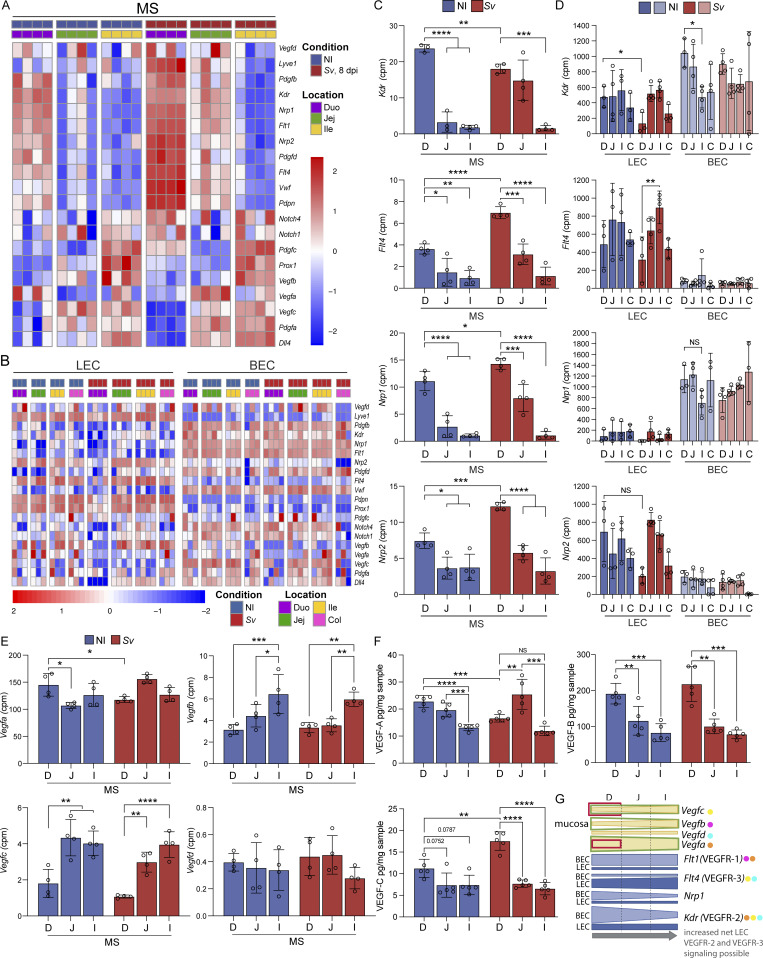
图6. VEGF信号梯度与乳糜管结构调控相关,感染诱导VEGF-C增加促进淋巴新生。
7. 蛔虫感染导致抗菌基因表达增强,但肠道菌群数量基本保持稳定,微生物减少非乳糜管结构改变主因
蛔虫诱导肠粘膜抗菌基因表达显著,但荧光原位杂交(FISH)及16S拷贝数定量显示肠腔菌群未有明显下降,组织黏膜微生物负荷局部减少。通过抗生素处理消减菌群后,乳糜管形态改变与蛔虫感染具有叠加效应,单纯菌群减少不能完全解释乳糜管“拉链”增加,意味着感染引发的免疫炎症而非微生物减少驱动淋巴管形态变化。
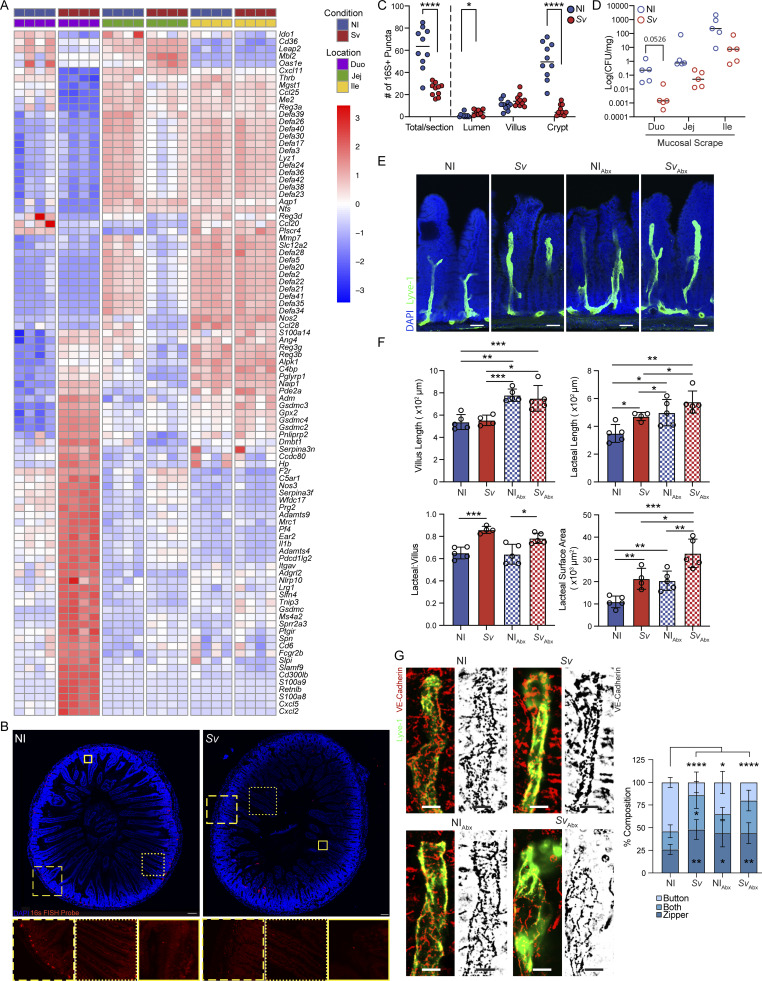
图7. 蛔虫感染后黏膜菌群变化有限,微生物减少非乳糜管形态变化主要机制。
8. 抗炎治疗(地塞米松)部分逆转感染引发的淋巴结构与脂质吸收障碍,确认炎症依赖性机制
地塞米松治疗蛔虫感染小鼠,显著降低免疫及血管发育相关基因表达,缓解乳糜管连接“拉链”状态,减少脂质积聚,部分恢复淋巴结构。这直接支持炎症介导的淋巴管生成及形态重构是感染改变乳糜管功能的核心机制。
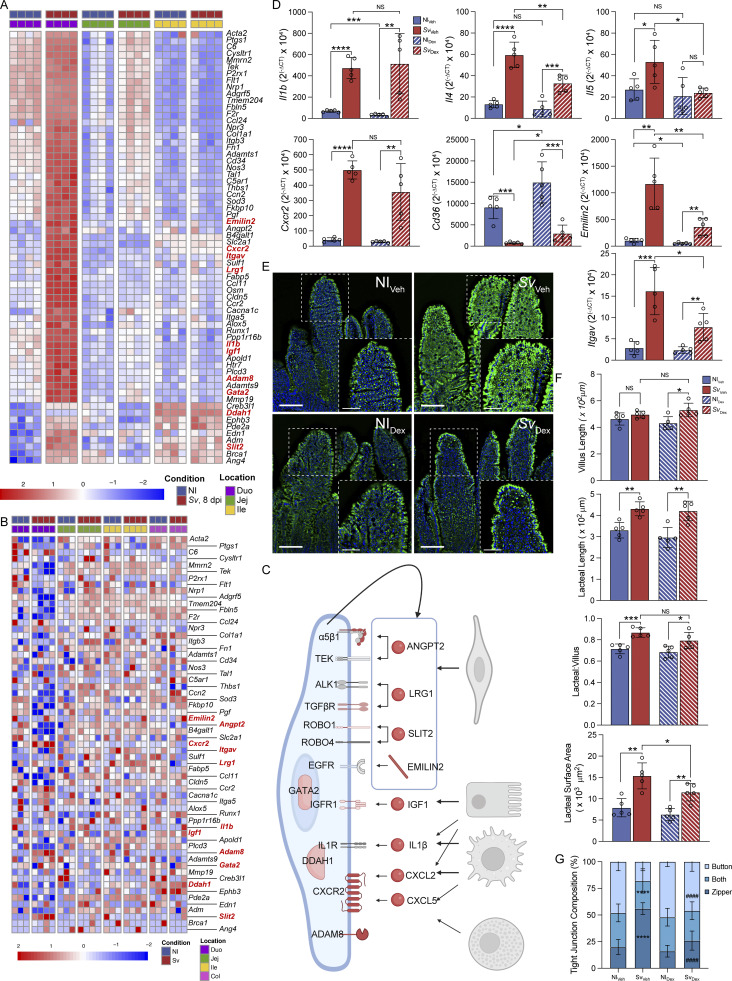
图8. 抗炎药地塞米松逆转蛔虫感染诱导的淋巴管结构与功能异常,确认炎症驱动机制。
研究意义与价值
本研究精细解析了肠道不同区域淋巴血管的功能适应性,确认十二指肠乳糜管为膳食脂质吸收的关键通路,并首次展示了寄生虫感染通过促进淋巴管新生及紧密连接增加,降低脂质出口效率,引发能量吸收下降,这一机制为寄生虫感染抗肥胖效应提供了新的解释。研究还强调淋巴内皮细胞作为微环境感应与反应的关键节点,其分子特征及功能可动态调整,提示针对淋巴系统的治疗可望获得新的疾病管理途径。
此外,区域性淋巴血管功能的揭示丰富了我们对肠道免疫屏障和代谢整合的理解,为未来治疗肥胖、炎症性肠病及寄生虫病相关代谢异常提供理论基础和治疗视角。
梅斯编辑点评
本项研究通过多层次、多技术手段,系统且全面地解析了肠道淋巴血管如何根据组织环境实现功能分化,并在寄生虫感染下完成结构与功能上的适应与修复。这不仅较好阐明了肠道淋巴系统的生理与病理变迁,也突破性地提出淋巴管新生与连接蛋白重编程在调控脂质吸收中的关键作用,为相关疾病的诊疗提供理论基础。尤其是在寄生虫感染影响脂质代谢方面,提出了富有启发性的机制模型,值得临床及基础研究进一步关注。
参考文献
-
Lane J.I., Nieves-Ortiz E., Ndatabaye O., Fatkhullina A.R., Lopez S., Dermody T.S., Esterházy D., Intestinal lymphatic vasculature is functionally adapted to different drainage regions and is altered by helminth infection. J Exp Med. 2025 Jun 12;222(9):e20241181. doi: 10.1084/jem.20241181. PMID: 40505102.
-
Bernier-Latmani J., Petrova T.V. Intestinal lymphatic vasculature: Structure, mechanisms and functions. Nat Rev Gastroenterol Hepatol. 2017 Jul;14(7):510-526. doi: 10.1038/nrgastro.2017.79.
-
Suh S.H., Choe K., Hong S.P., et al. Gut microbiota regulates lacteal integrity by inducing VEGF-C in intestinal villus macrophages. EMBO Rep. 2019 May;20(5):e46927. doi: 10.15252/embr.201846927.
-
Zhang F., Zarkada G., Yi S., Eichmann A. Lymphatic endothelial cell junctions: Molecular regulation in physiology and diseases. Front Physiol. 2020 Mar 24;11:509. doi: 10.3389/fphys.2020.00509.
原始出处:
Lane JI, Nieves-Ortiz E, Ndatabaye O, Fatkhullina AR, Lopez S, Dermody TS, Esterházy D. Intestinal lymphatic vasculature is functionally adapted to different drainage regions and is altered by helminth infection. J Exp Med. 2025 Sep 1;222(9):e20241181. doi: 10.1084/jem.20241181I
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











前往app查看评论内容
0 0
前往app查看评论内容
2 0
#蛔虫# #蛔虫病# #肠道淋巴血管# #小肠淋巴系统#
8