第24轮长征疑难肿瘤MTB会议,精准诊疗MSS型肠癌患者长期获益,解析罕见EGFR19delins突变特征、机制及耐药后治疗方案
2022-11-16 找药宝典 找药宝典
10月19日,第24轮长征疑难肿瘤分子肿瘤专家委员会(Molecular Tumor board,MTB)在长征医院如期举行。MTB是一种多学科协作的模式,整合多样化的患者信息,从分子层面讨论晚期肿瘤
10月19日,第24轮长征疑难肿瘤分子肿瘤专家委员会(Molecular Tumor board,MTB)在长征医院如期举行。MTB是一种多学科协作的模式,整合多样化的患者信息,从分子层面讨论晚期肿瘤患者的治疗问题。长征医院MTB会议由海军军医大学附属长征医院肿瘤科臧远胜主任团队领衔发起,以研讨疑难肿瘤患者最佳治疗方案为特色,以提高疑难肿瘤患者治疗远期效果、为患者赢得生存获益为目标。本次MTB讨论的两个病例分别由临床专家王湛教授和焦晓栋教授带来,同时参与本次讨论的有分子生物学专家温丰彩博士、朱明骏博士,生物信息学专家张丁博士以及众多肿瘤科临床医生。

案例一:
患者基本病情:
患者女性,71岁,2020年7月自觉颈部淋巴结肿大,CT提示左侧腋下多发肿大淋巴结,纵隔稍大淋巴结,行左颈侧淋巴结切除术,病理提示腺癌,考虑转移性,消化道来源可能。8月肠镜提示“乙状结肠巨大溃疡型新生物”。活检病理提示“乙状结肠黏液腺癌”,PET-CT(2020-8-6)示“乙状结肠癌,盆腔、腹膜后、纵隔、左腋窝、左锁骨上、左颈部淋巴结转移”。
2020年8月18日入我科完善化验及基线影像学检查,入组APICAL-CR临床研究,于8月21日至2021月5月13日给予安罗替尼+信迪利单抗治疗,q3w,共13个周期,期间因不良反应安罗替尼减量使用,4周期疗效评价为PR,10周期疗效评价为SD;
2021年6月4日至2021年11月19日继续安罗替尼+信迪利单抗治疗,12月14日左腋下肿物活检病理提示为转移性腺癌,结果患者影像学检查,疗效评价为PD;
2021年12月至2022年2月25日改用FOLFOX+贝伐单抗治疗(q2w)5周期后评估为缓慢进展的SD,酌情将5-FU调整为雷替曲塞;4月21日予以奥沙利铂+雷替曲塞+贝伐单抗治疗;
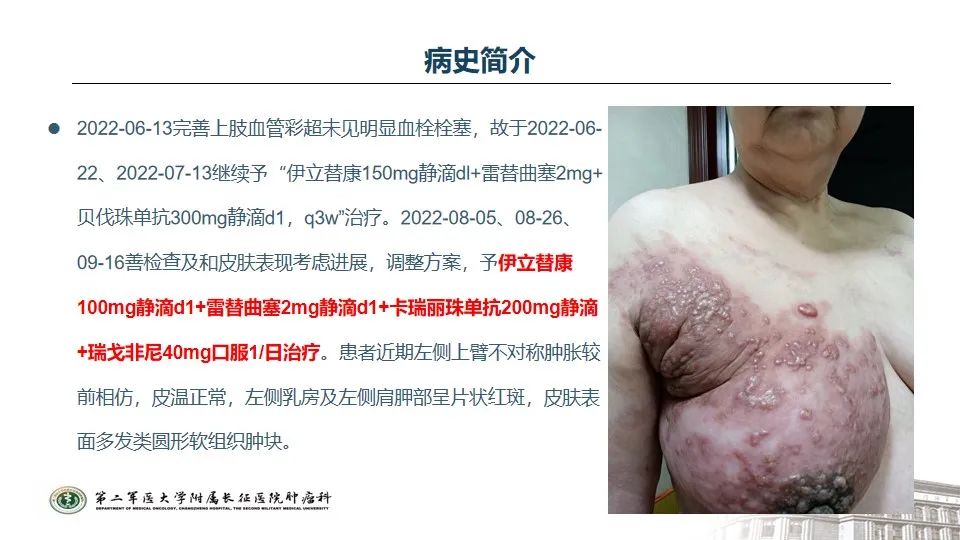
2022年5月21日调整治疗方案,具体为伊立替康+雷替曲塞+贝伐单抗,q3w,后因左前臂不对称肿胀暂缓贝伐单抗,6月2日调整方案为伊立替康+雷替曲塞;2022年6月13日完善上至彩超未见明显血栓栓塞,故于6月22日、7月13日给与伊立替康+雷替曲塞+贝伐单抗治疗, q3w;
2022年8月5日、08-26、09-16善检查及和皮肤表现考虑进展,调整方案,予伊立替康+雷替曲塞+卡瑞利珠单抗+瑞戈非尼治疗。患者近期左侧上臂不对称肿胀较前相仿,皮温正常,左侧乳房及左侧肩胛部呈片状红斑,皮肤表面多发类圆形软组织肿块。
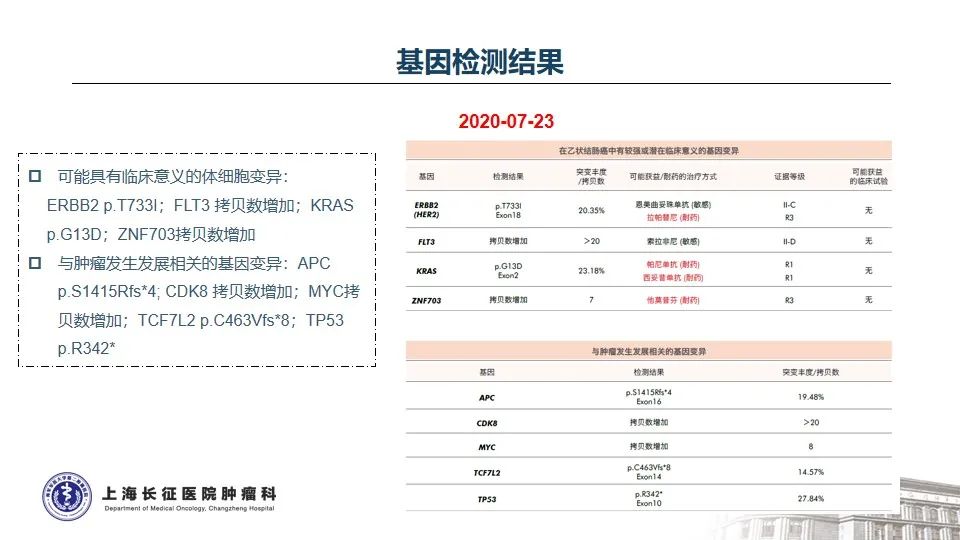
基因检测结果(2020年7月23日):
测得ERBB2 T733I突变、KRAS G13D突变、FLT3拷贝数增加、ZNF703拷贝数增加等
讨论问题:
1. 本次检出ERBB2、KRAS突变及FLT3拷贝数增加的临床意义
2. 结直肠癌的免疫治疗
分子生物学分析(分子生物学家温丰彩):
1. HER2突变结直肠癌的靶向治疗证据有限
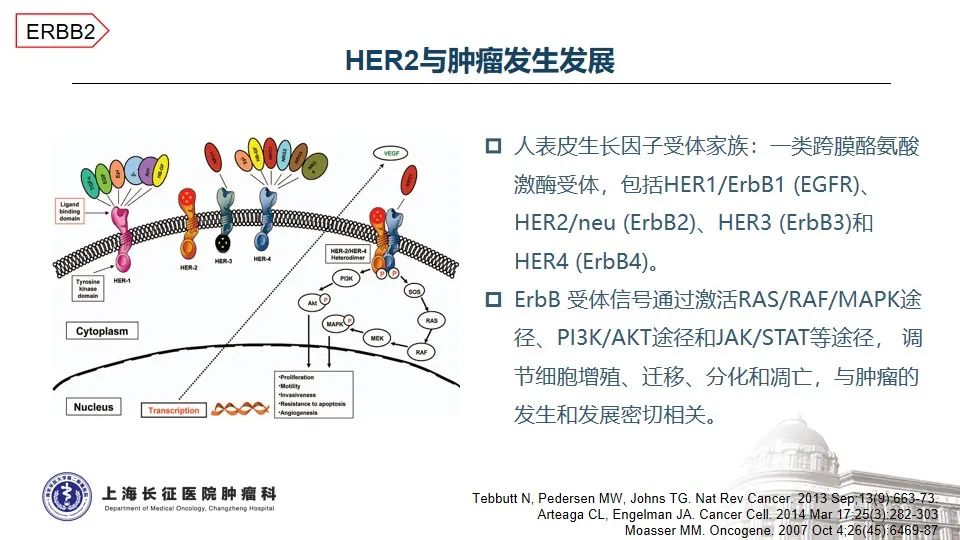
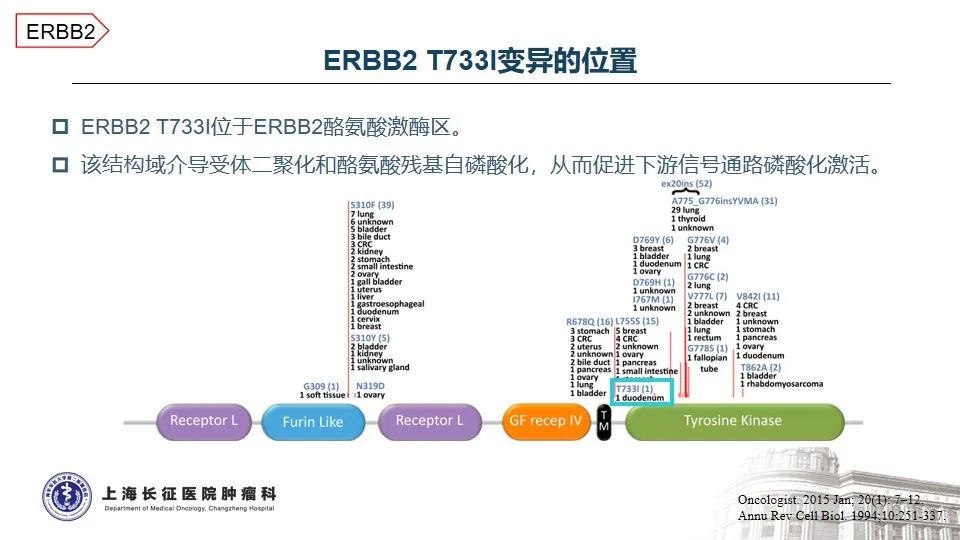
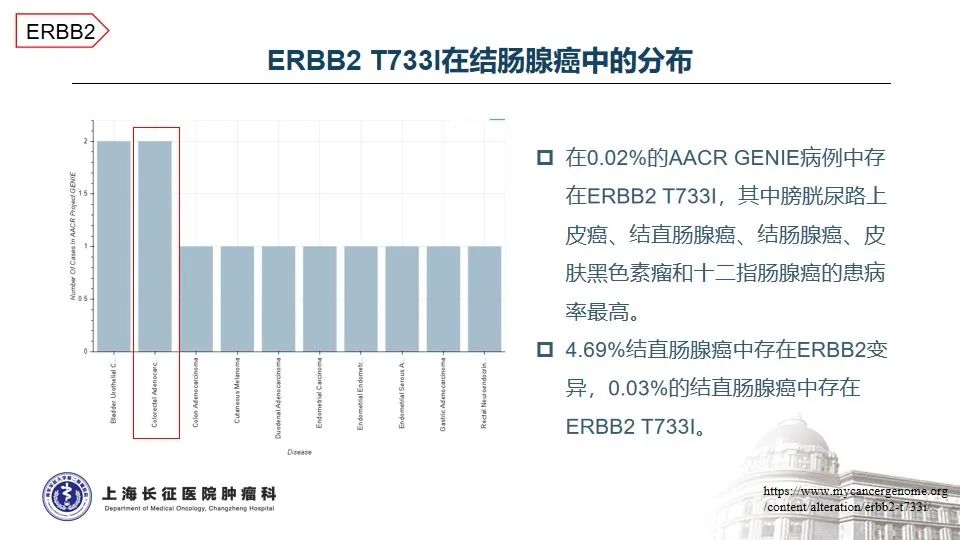
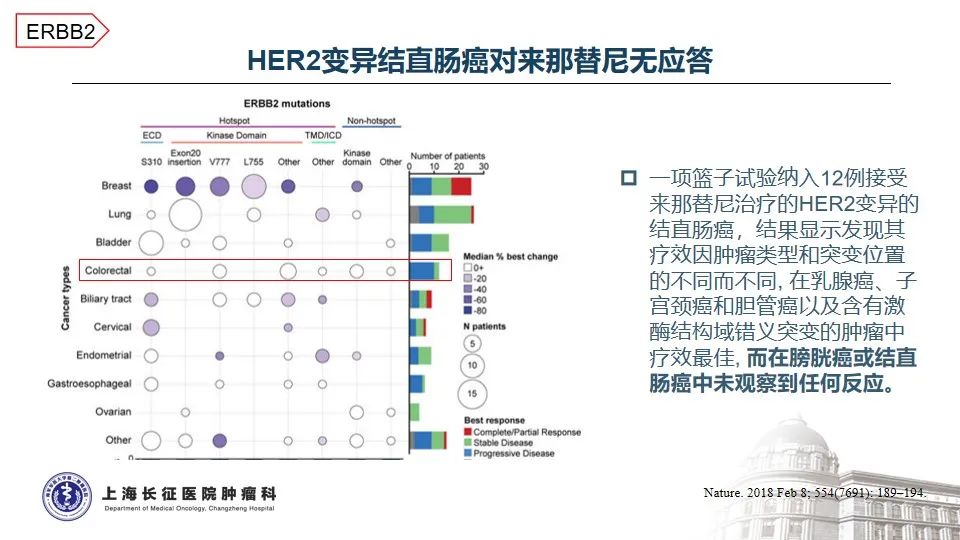
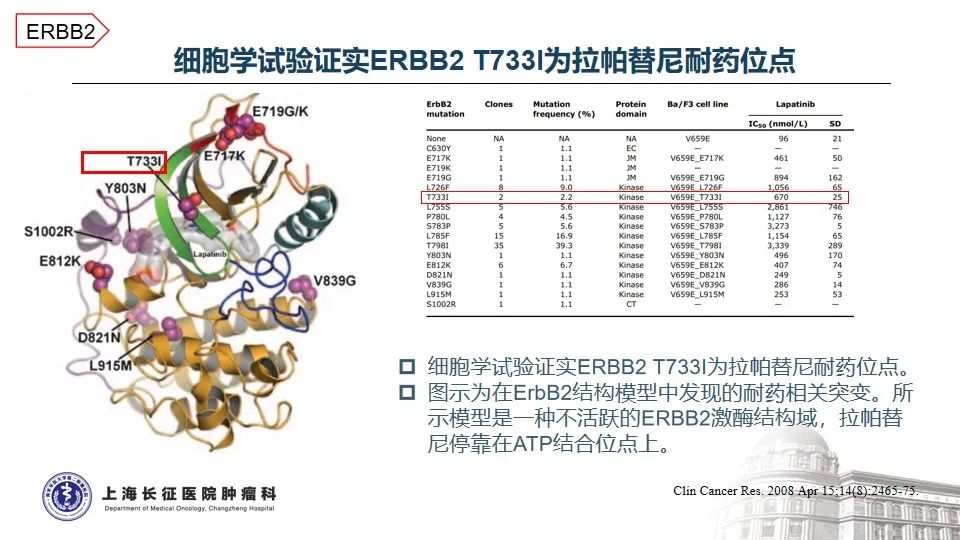
HER2是人表皮生长因子受体家族的重要成员之一,参与调节细胞的增殖、迁移、分化和凋亡,与肿瘤的发生和发展密切相关1-2。在结直肠癌中,HER2基因异常比例为2-6%,其中点突变约占3% 3。本例患者所携带的HER2 T733I变异位于酪氨酸激酶结构域,该变异将引起激酶的异常活化。AACR GENIE数据库中,仅在0.03%的结直肠癌患者中测得该变异,提示HER2 T733I变异极为罕见。
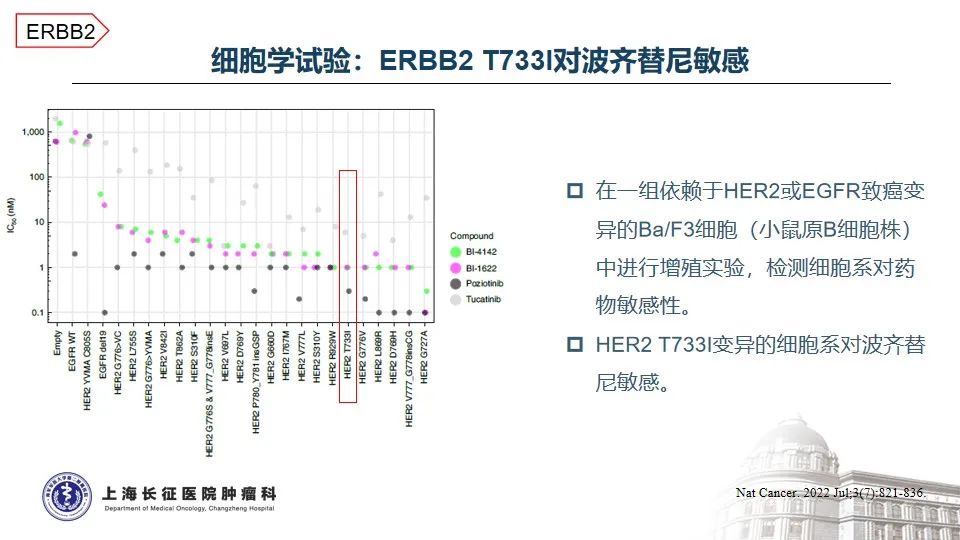
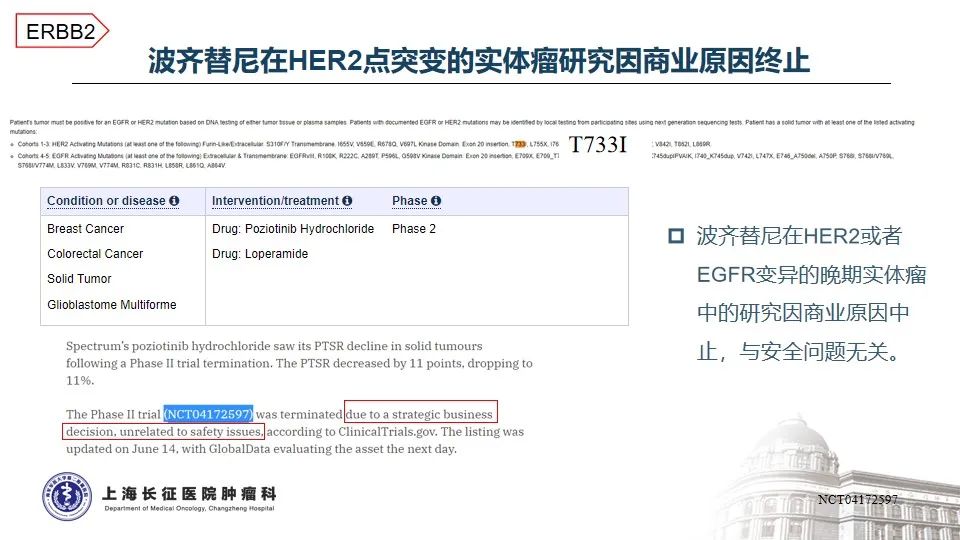
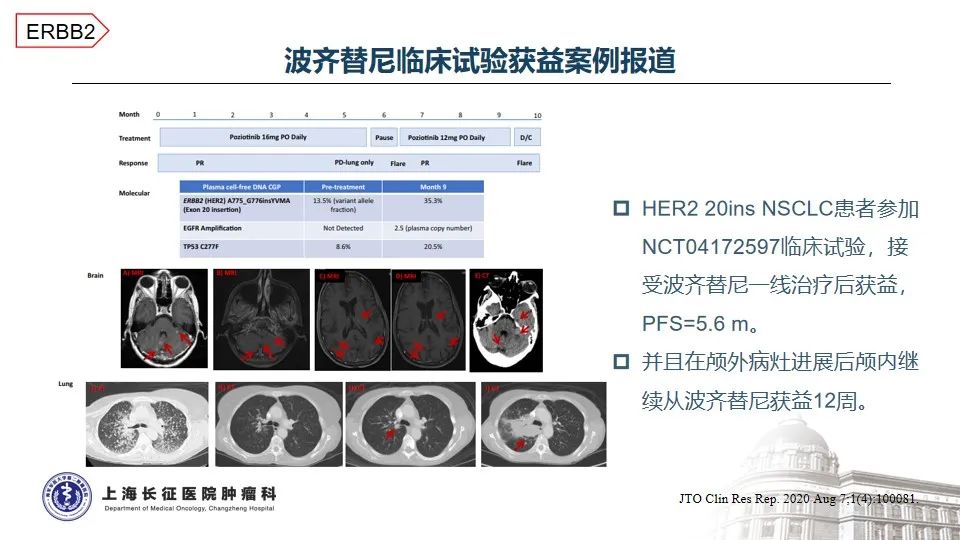
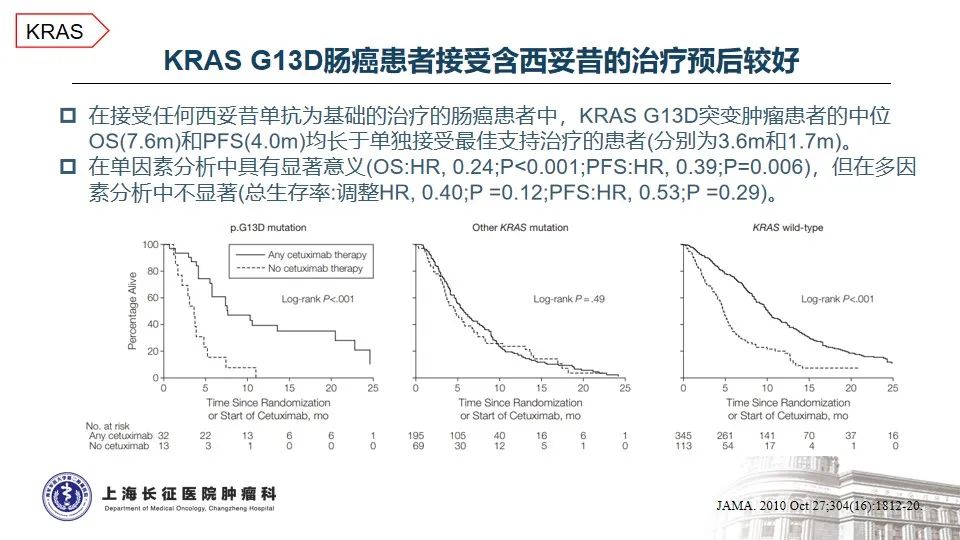
治疗方面,基于TRIUMPH、TAPUR以及HERACLES-A等研究,曲妥珠单抗联合帕妥珠单抗或拉帕替尼治疗HER2阳性的晚期结直肠癌已成为NCCN指南推荐的标准治疗方案4-7,然而,无论曲帕联合,还是单抗联合小分子TKI均未在HER2点突变的晚期结直肠癌中看到特别明确的临床获益8-10。随着抗体偶联药物的发展,在一项T-DXd(DS8201)治疗HER2突变实体瘤的研究中,1位携带HER2 T733I变异的患者经T-DXd治疗后的最佳疗效为SD,疾病稳定维持时间未知11。
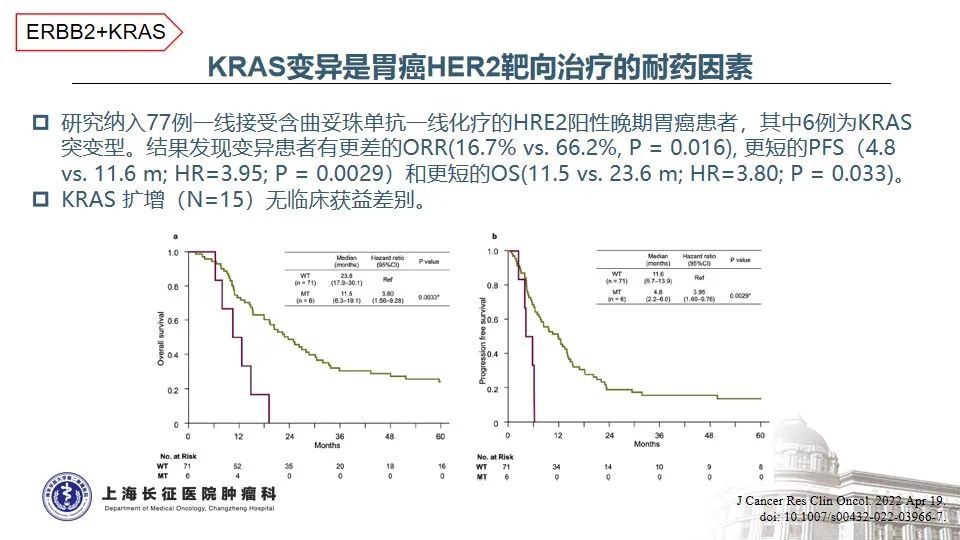
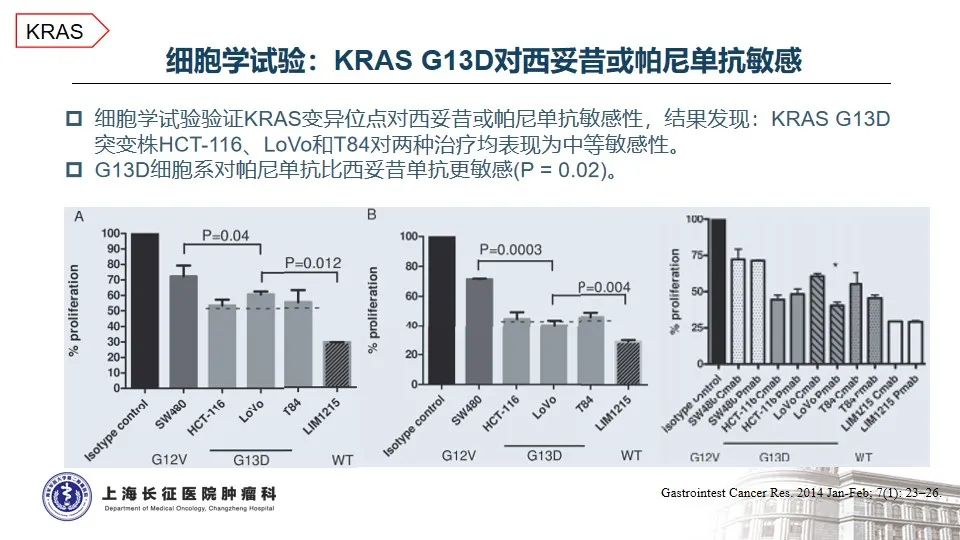
2. KRAS和HER2同时突变或将影响靶向治疗的疗效
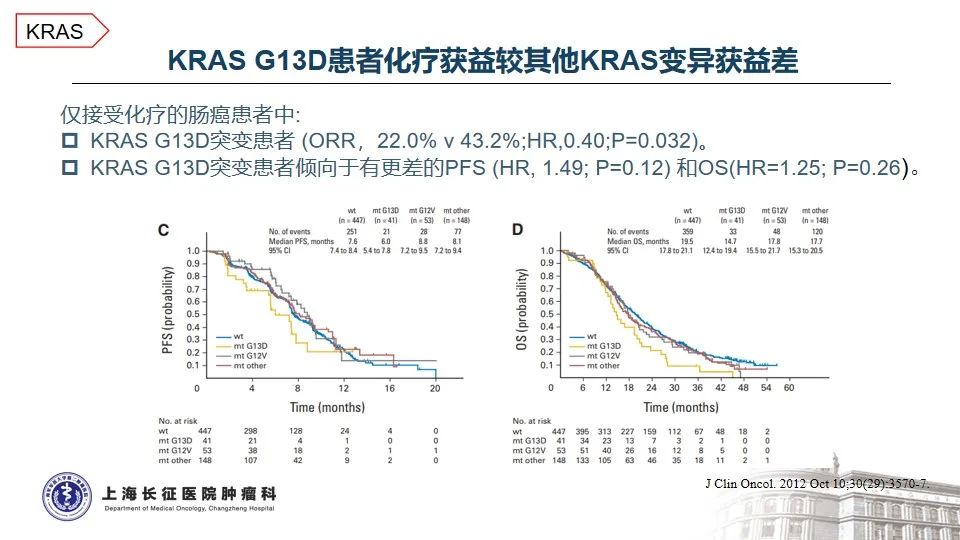
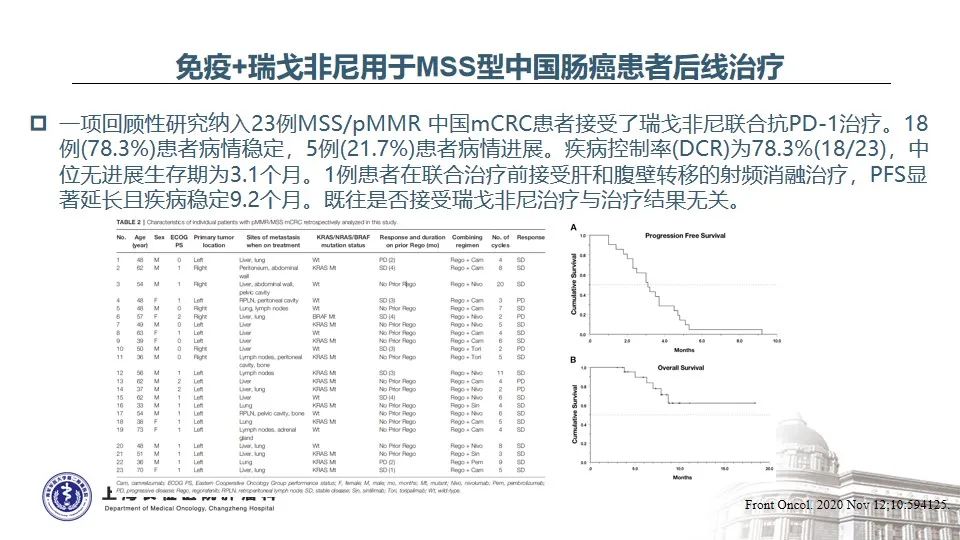
本患者携带的KRAS G13D突变是结直肠癌中KRAS基因上经典的变异之一,通常携带该变异的结直肠癌患者预后更差、生存时间更短12,13。结直肠癌中,鲜有HER2伴KRAS突变的研究或案例报道,借鉴HER2阳性的胃癌,KRAS基因的继发性突变通常是一线接受抗HER2治疗失败耐药的关键因素14,因此提示:由于下游KRAS G13D突变的存在,针对HER2变异靶向治疗的疗效可能会受影响,尝试时需谨慎并适当加强随访。
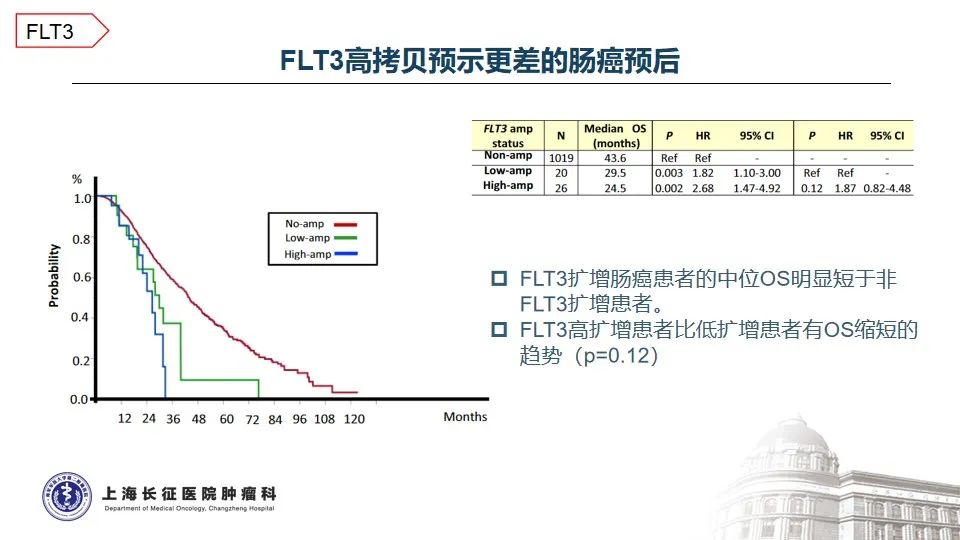
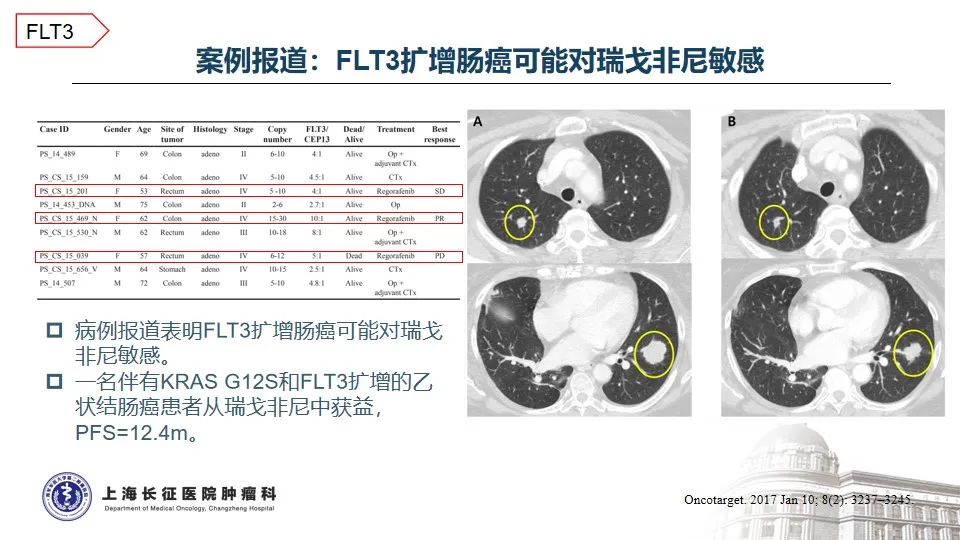
3. FLT3基因扩增在结直肠癌中并不常见,通常预示预后不佳
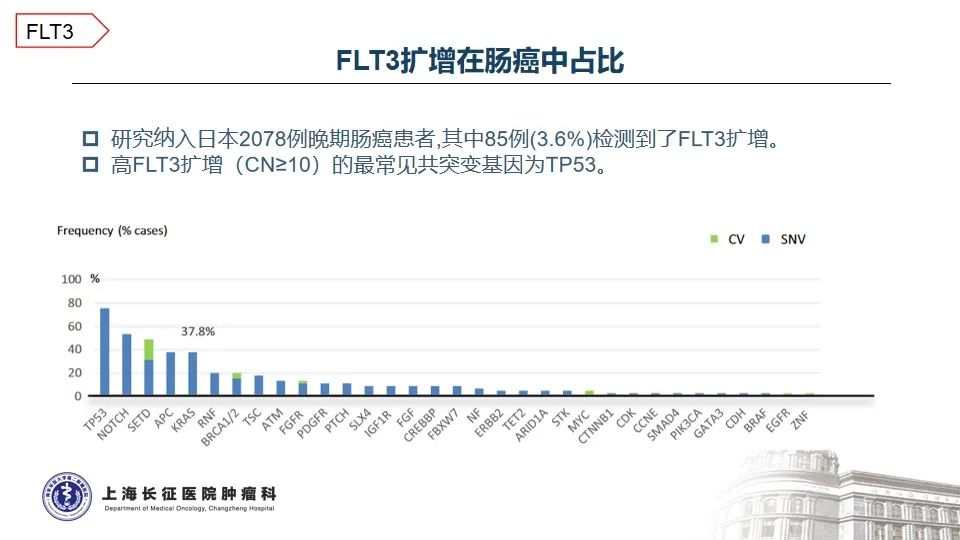
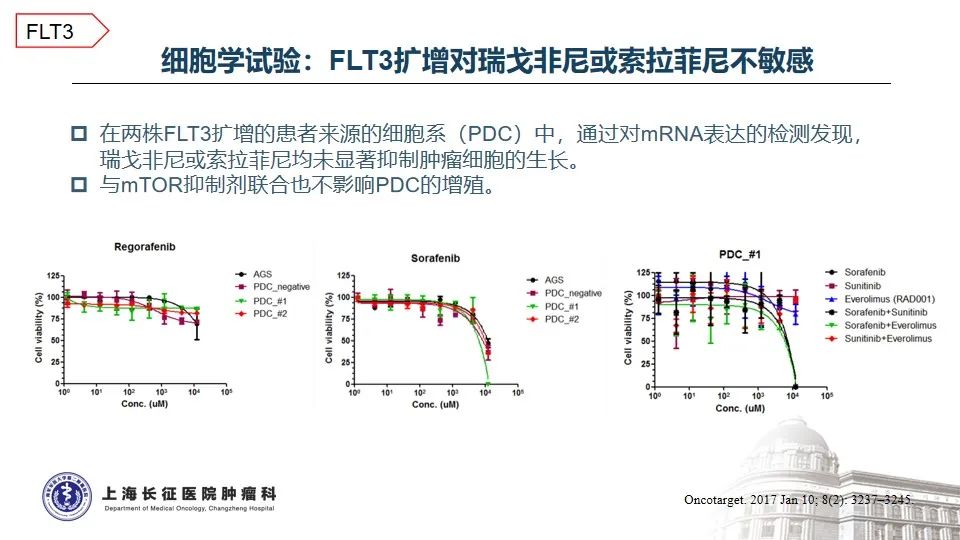
FMS样酪氨酸激酶3(FLT3)是III类受体酪氨酸激酶家族成员之一,常在造血祖干细胞中表达,在控制造血前体的增殖和分化中起着关键作用。日本结直肠癌患者大样本报道,FLT3基因扩增约占3.6%,FLT3扩增的肠癌患者中位OS明显短于FLT3基因正常的患者15。在实体瘤中,特异性靶向FLT3扩增的抑制剂尚属临床开发早期,广谱酪氨酸激酶抑制剂如索拉菲尼、瑞戈非尼等用于多线化疗治疗失败的结直肠癌患者曾有获益的案例报道16-17。一名伴有KRAS G12S和FLT3扩增的乙状结肠癌患者标准治疗失败后,瑞戈非尼单药治疗的无进展生存期为12.4个月16。
4. 结直肠癌免疫联合治疗初显疗效
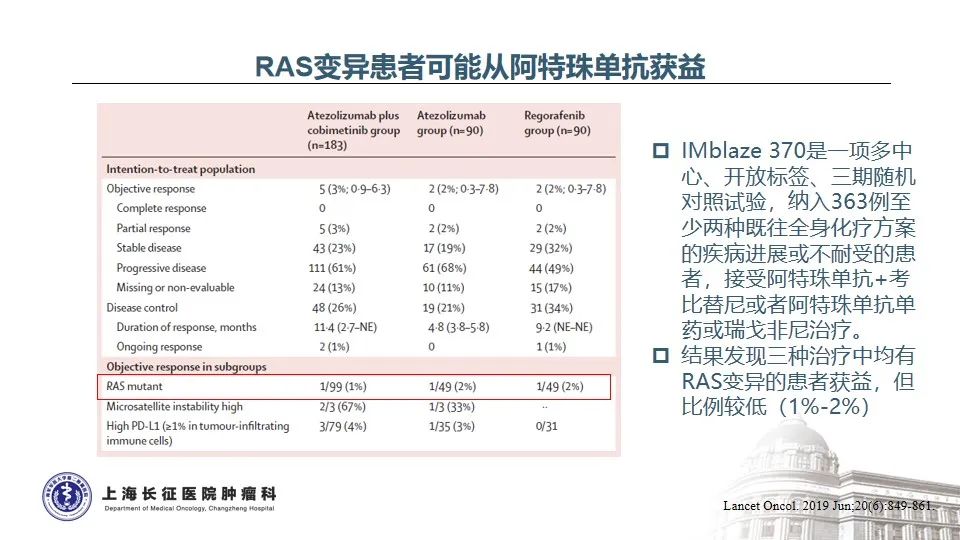
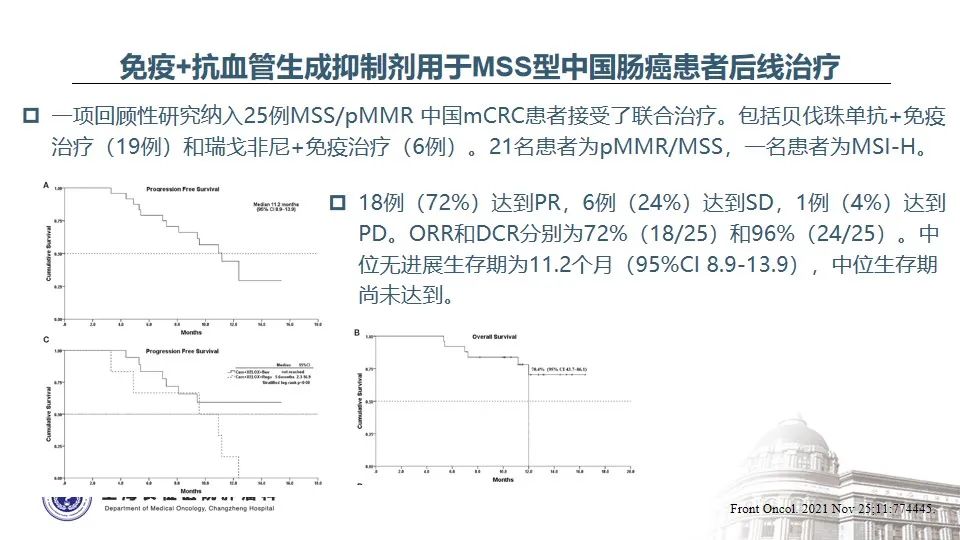
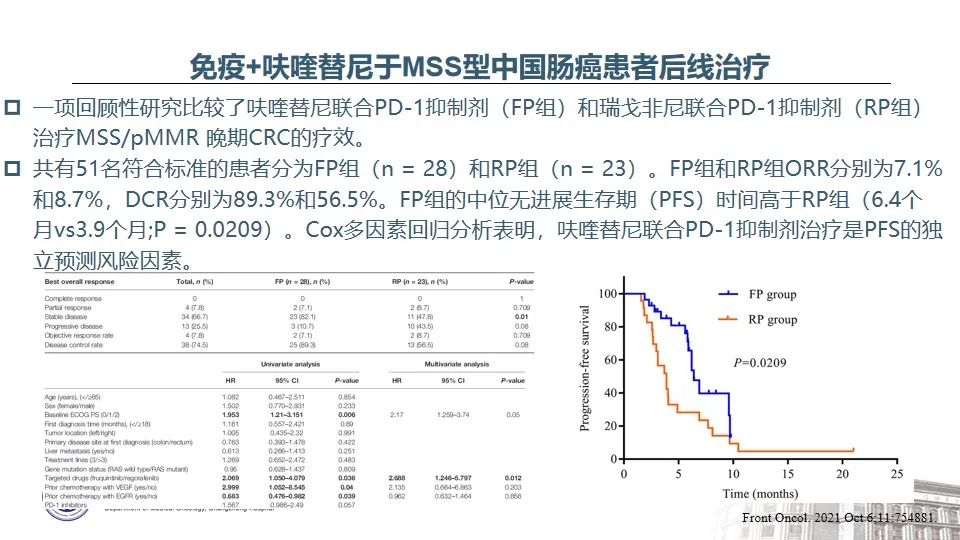
REGONIVO研究是免疫联合抗血管生成抑制剂用于晚期后线MSS型结直肠癌取得了令人鼓足的临床疗效,ORR高达30%,mPFS为7.9个月18,由此引发了国内外众多关于抗PD-1免疫治疗联合抗血管生成药物的尝试和探索,尽管总体ORR在0-20%之间,未复制出REGONIVO研究的结果19-23,但亚组分析表明,不存在肝转移的肠癌患者更能从免疫联合TKI治疗中获益。正如本例乙状结肠癌患者存在全身多处淋巴结的广泛转移,但未见肿瘤侵袭肝脏,该患者从安罗替尼+信迪利单抗的联合治疗中获得了长达14个月的无进展生存期。
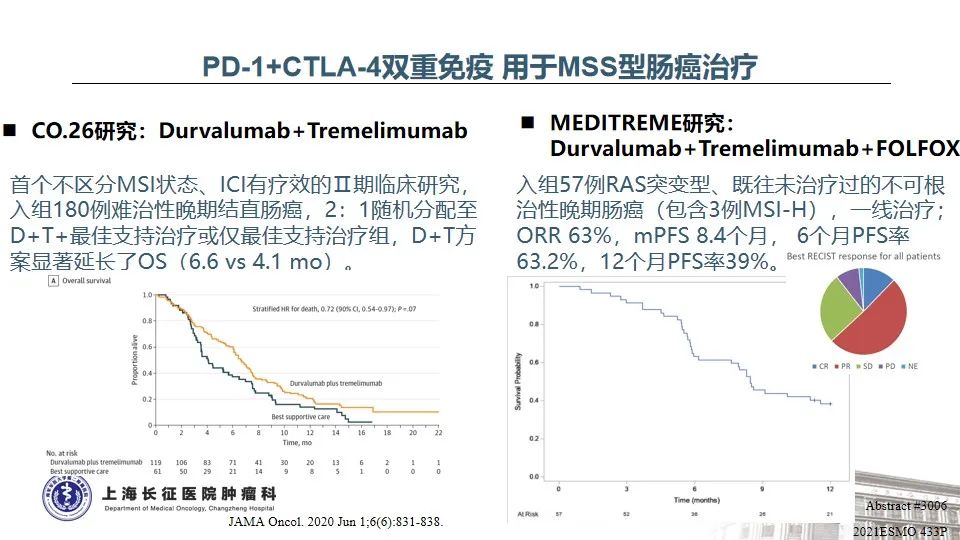
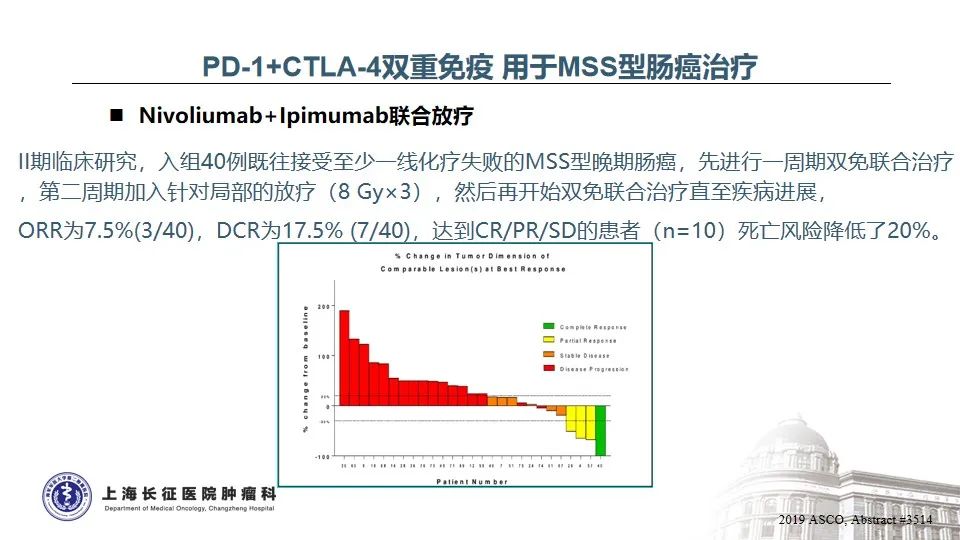
除了免疫联合TKI以外,PD-1+CTLA-4双重免疫也在展示出一定的疗效,在CCTG CO.26研究中,Durvalumab联合Tremelimumab+最佳支持治疗(BSC)用于对所有治疗不敏感的晚期结直肠癌患者,与BSC相比,总生存期延长了2个月(6.6 vs 4.1 个月),但未见PFS和ORR的改善24。
临床团队分析和方案选择(王湛教授):
患者的基因检测结果表明本患者同时携带HER2、KRAS、FLT3等基因的突变或扩增,提示其肿瘤异质性高,预后较差,因此单一类型的药物很难遏制疾病的进展。尽管针对患者所携带的ERBB2 T733I点突变目前没有特别强的靶向治疗证据,但由于该变异丰度较高,提示其肿瘤驱动能力较强,需进行针对性地进行抑制。另外,鉴于存在FLT3扩增患者从瑞戈非尼中获益的案例报道,因此在和患者充分沟通告知后,治疗组于2022年9月17日开始加用吡咯替尼治疗,即采用伊立替康+雷替曲塞+卡瑞利珠单抗+瑞戈非尼+吡咯替尼五药联合“鸡尾酒式”的治疗方案;目前已完成2个疗程的治疗,等待疗效评估。
其他临床专家观点:
秦保东教授:本案例为一例乙状结肠癌患者,值得注意的是,其肿瘤转移部位并非肠癌常见的肝、肺转移,而是腋窝、锁骨上淋巴结的广泛转移,从科研层面,其特殊转移方式背后的驱动因素值得进一步探索。治疗层面,免疫联合抗血管生成药物曾在一线持久有效地控制了肿瘤,个人认为在多线化疗失败、几乎无药可用时,再考虑免疫重启是可行的,但建议使用不同的PD-1抗体或采用PD-1/CTLA-4双抗进行尝试。
焦晓栋教授:本患者的后续治疗选择主要基于2020年7月的NGS检测结果,这是患者在未进行系统治疗时取样的,在经过了多种化疗、靶向、免疫等药物治疗后,患者的肿瘤突变情况可能已发生了改变,如果可行,建议再次检测患者的新发病灶组织或ctDNA,以更好地指导后续用药。
臧教授总结:
1. 个性化治疗和及时的方案调整为患者赢得更长生存
在患者初始身体状态不佳、不能耐受一线化疗的情况下,治疗组优先推荐患者入组安罗替尼联合信迪利单抗的临床研究,这给患者带来了持久的疾病控制的同时,也有利于患者体力的逐步恢复。一线治疗失败后,治疗组及时给予化疗,并根据患者实际情况不断微调和优化治疗方案以减少化疗的不良反应。截至目前,已为这例高龄结肠癌患者赢得了27个月的生存时间,这是一个非常成功的精细化治疗案例,实属不易。
2. 疑难肿瘤的创新治疗需有的放矢
疑难肿瘤的创新治疗主要针对的是无标准治疗方案的晚期后线肿瘤患者。在开展创新治疗过程中,患者的治疗意愿和经济承受能力以及如何选择临床可及、高效低毒的治疗方案等都是临床医生考量的关键因素。回归到本患者,在她治疗意愿和经济承受能力许可的情况下,临床医生更应该积极地为患者寻找更优的创新治疗方案,如再次检测以发现新靶点或尝试PD-1/CTLA4双抗等新型药物。
3. 精准的治疗方案离不开精准的诊断
本患者的基因检测是两年前刚确诊时进行的,在多种治疗药物的选择压力下,患者的肿瘤分子特征和微环境或许已发生了重大改变,而这种改变我们临床医生是无从预判的,必须依赖最新的基因检测结果为后续治疗提供依据。此外,我们也可以借助类器官模型、CAR-T等新技术为患者摸索后续的治疗方向。关于本患者的后续治疗方案,从HER2靶向治疗的角度,尽管DS8201的疗效似乎优于曲妥珠单抗和小分子TKI,但是证据级别依然不够,同时DS8201潜在的安全性问题也是需要我们警惕的。鉴于患者曾获益于免疫联合抗血管生成药物,我个人认为,PD-1/CTLA-4双抗联合低剂量化疗不失为一种相对安全有效的选择。
案例一详情:




















右滑查看更多
案例二:
患者基本病情:
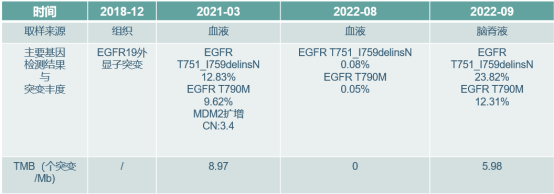
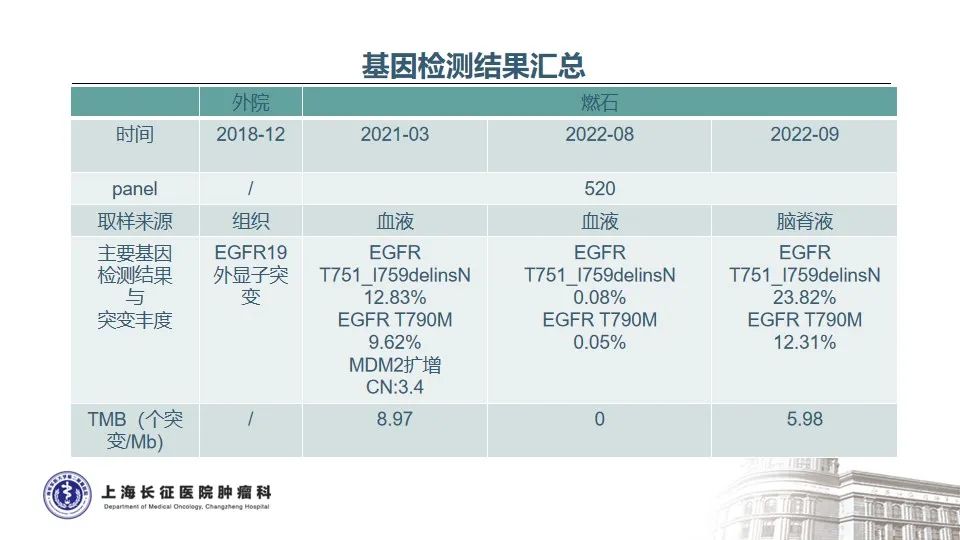
患者薛某,男性,61岁;2018年12月胸部CT示:右肺下叶见分叶状肿块,大小48*28mm,明显强化,牵拉胸膜,考虑恶性病变;两肺门及纵隔未见明显肿大淋巴结影;两侧胸膜局部增厚;20日右肺病灶穿刺活检,穿刺报告结果示:(右肺穿刺活检)恶性肿瘤,结合免疫组化符合低分化非小细胞肺癌,倾向腺癌;基因检测结果示:EGFR19外显子突变;
2019年1月至2021年3月口服易瑞沙靶向治疗,期间评估稳定;
2021年3月复查CT示:右下肺占位较前略有增大,心包积液,基因检测回示:EGFR T790M突变;
2021年3月24日方案调整为奥希替尼靶向治疗,期间病情评估为稳定;
2022年3月,患者开始出现视物模糊重影,头晕,无头痛、呕吐,因疫情未进一步检查。2022年7月27外院头颅MR增强示右侧额叶、左侧额顶叶多发小片强化灶,结合病史转移性肿瘤不除外。评估病情PD。再次行血基因检测:EGFR T790M;
2022年8月2日更换三线方案,具体为:白蛋白结合紫杉醇400mg静滴d1 +卡铂400mg静滴d1 +安维汀500mg静滴d1,q3w;1周后患者出现乏力、视物重影加重,头痛、头晕加重,食欲减退伴恶心呕吐。入院后经积极脱水、降颅压、止吐、止痛治疗后症状改善不明显,结合影像学表现,考虑脑膜转移;
最终诊断:1.肺癌 右肺下叶 腺癌cTxNxM1 (骨、脑) IV期 ECOG 3 2.脑膜继发恶性肿瘤
基因检测结果汇总:
讨论问题:
1、EGFR 19del的特殊类型:EGFR T751_I759delinsN与常见的19del突变有何不同?
2、肺癌脑膜转移的治疗有何进展?
分子生物学分析(分子生物学家朱明骏):
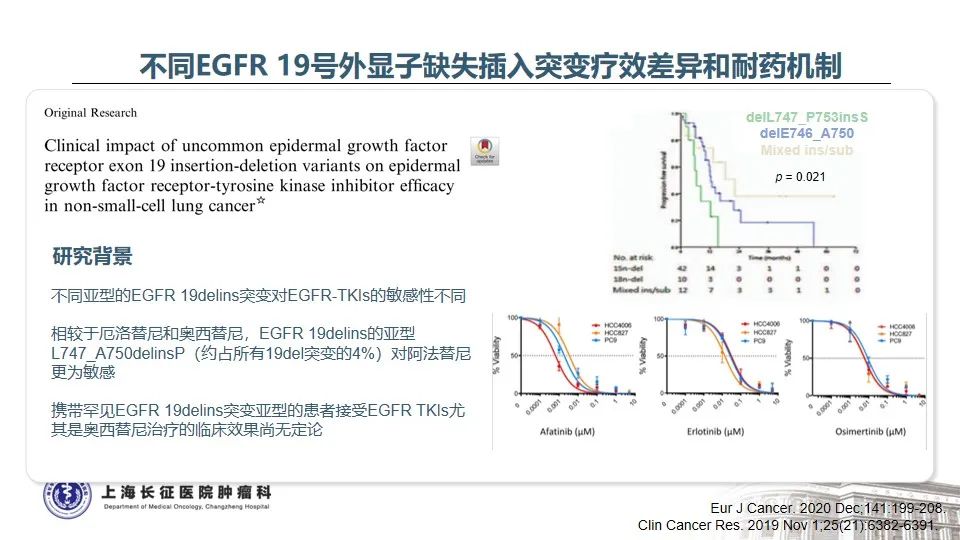
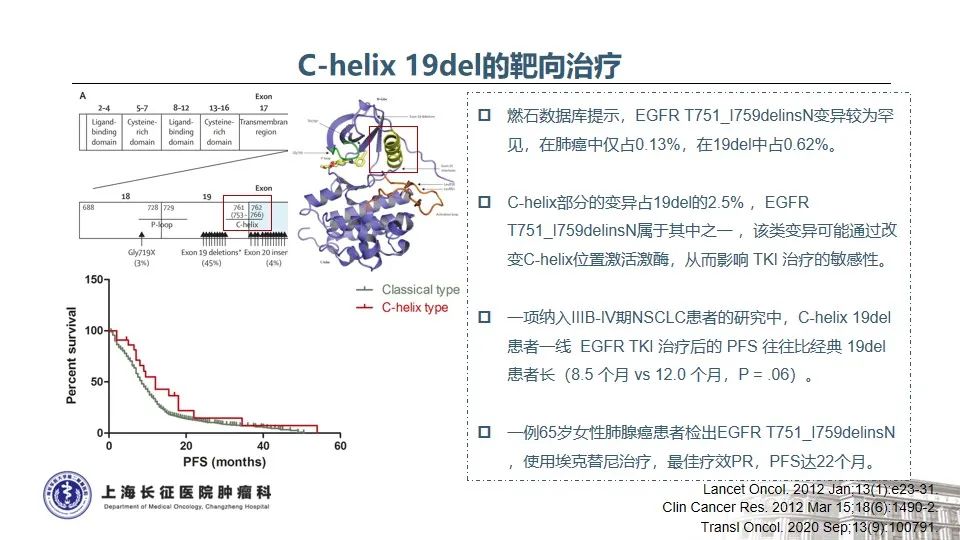
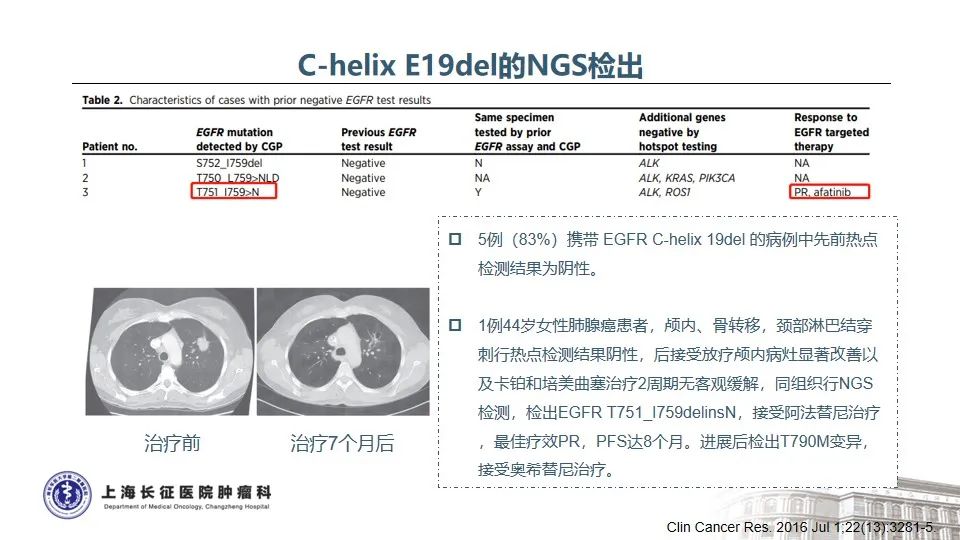
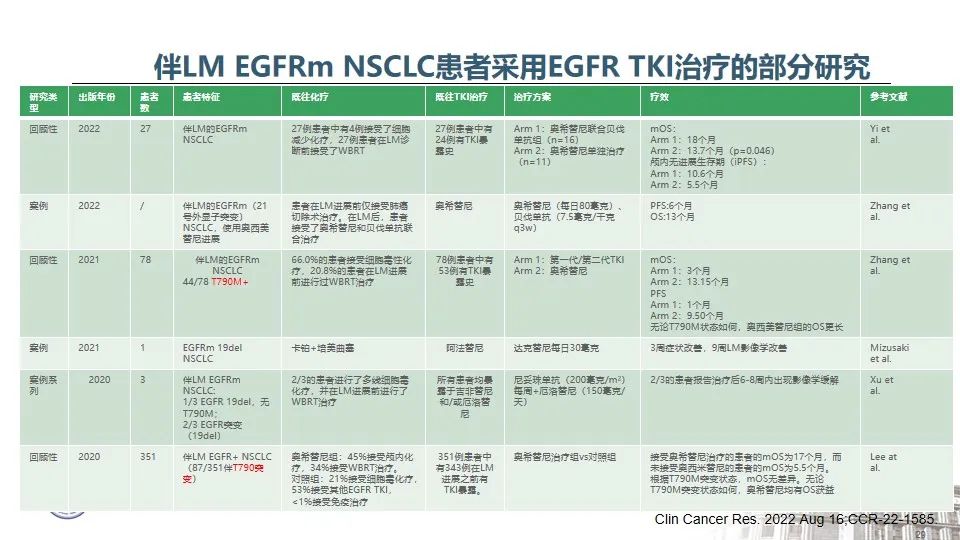
1. EGFR 19delins是一种罕见且特殊的19del亚型,一线可从一代EGFR TKI中获益更持久
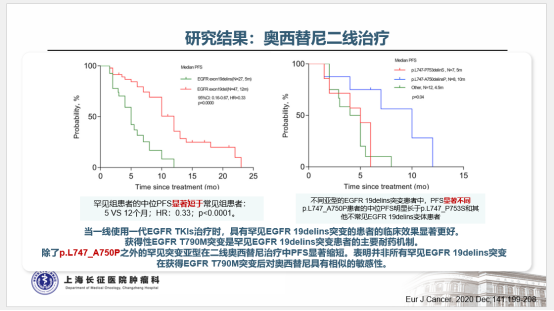
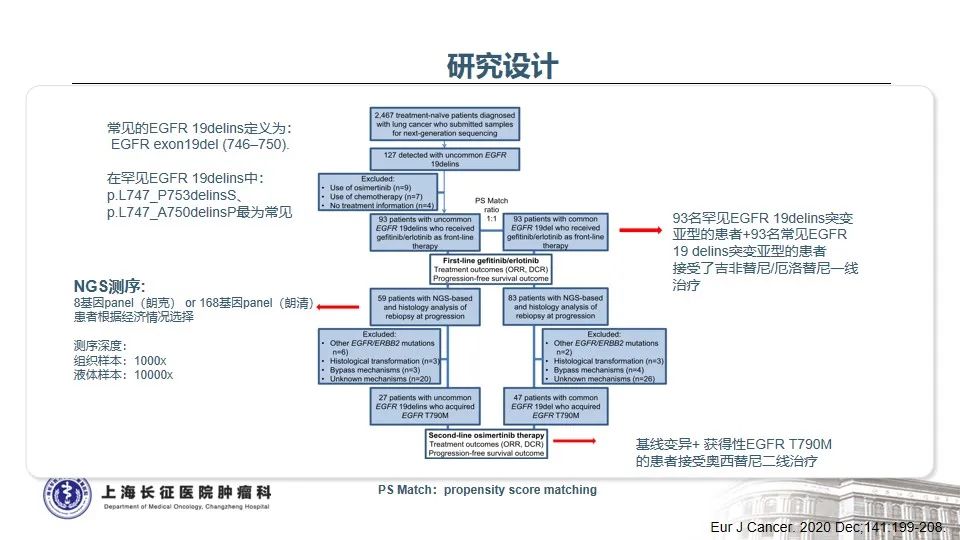
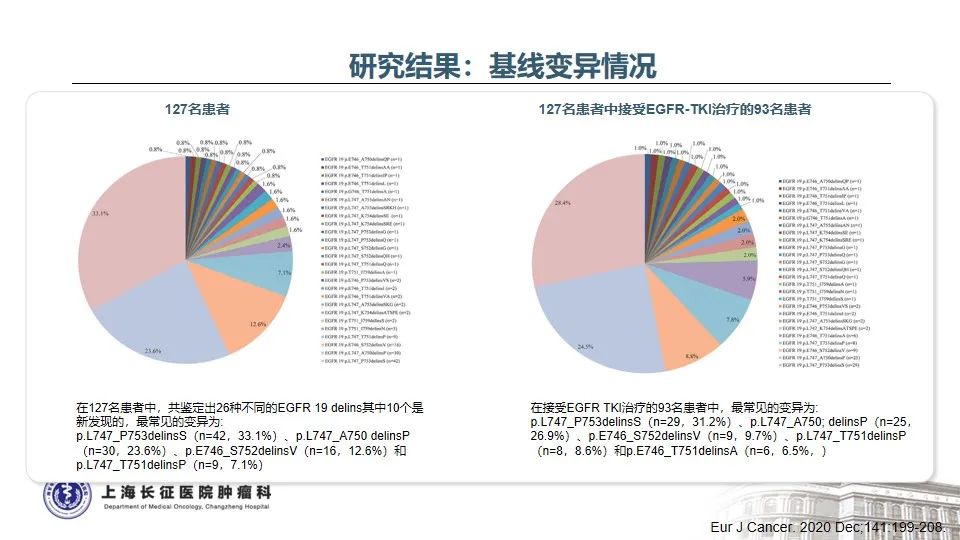
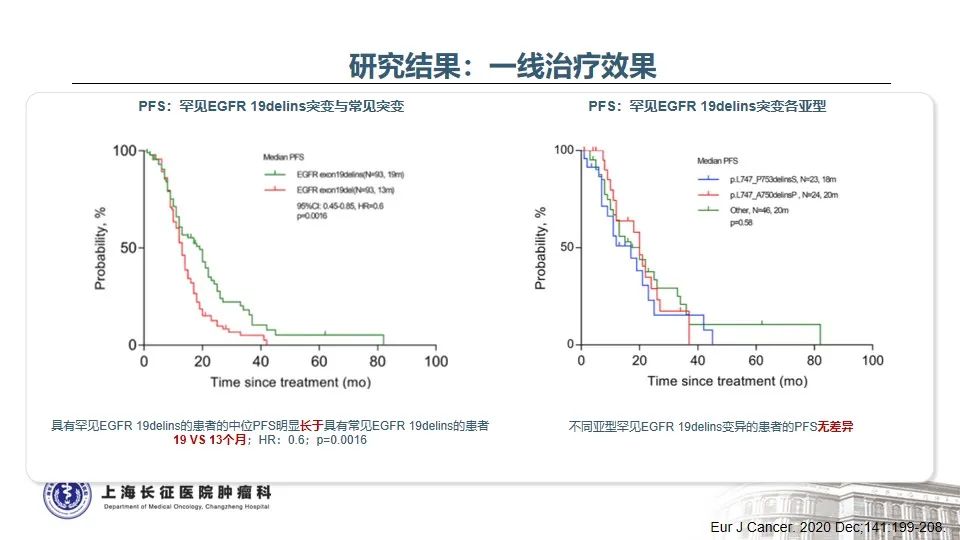
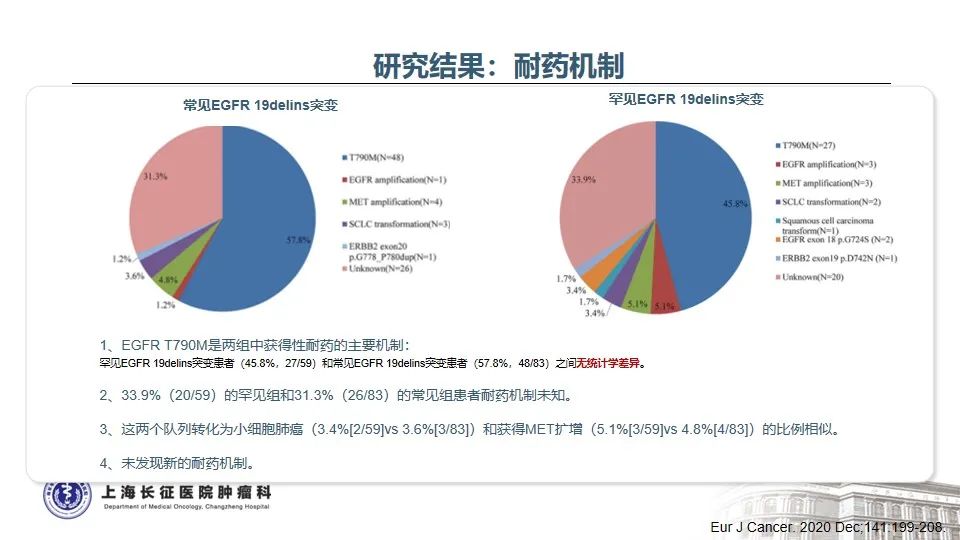
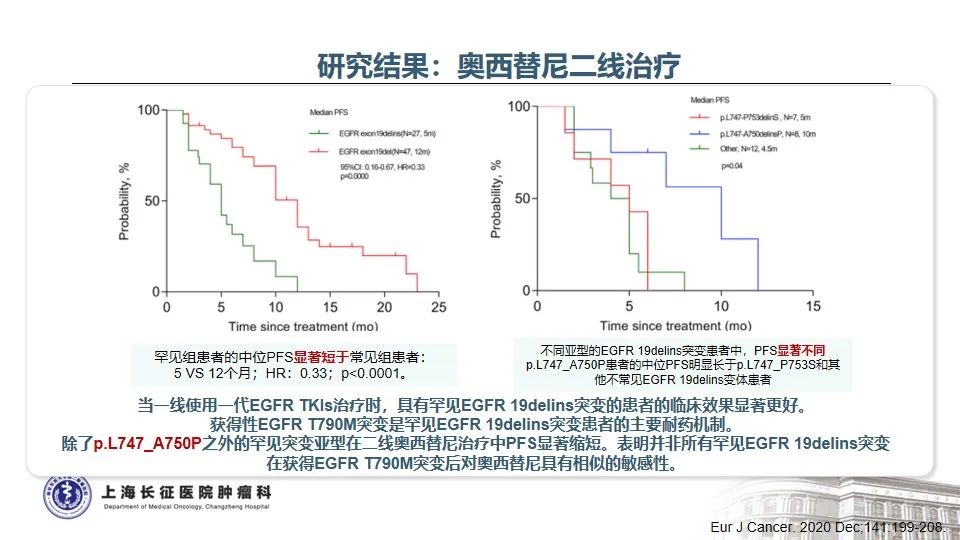
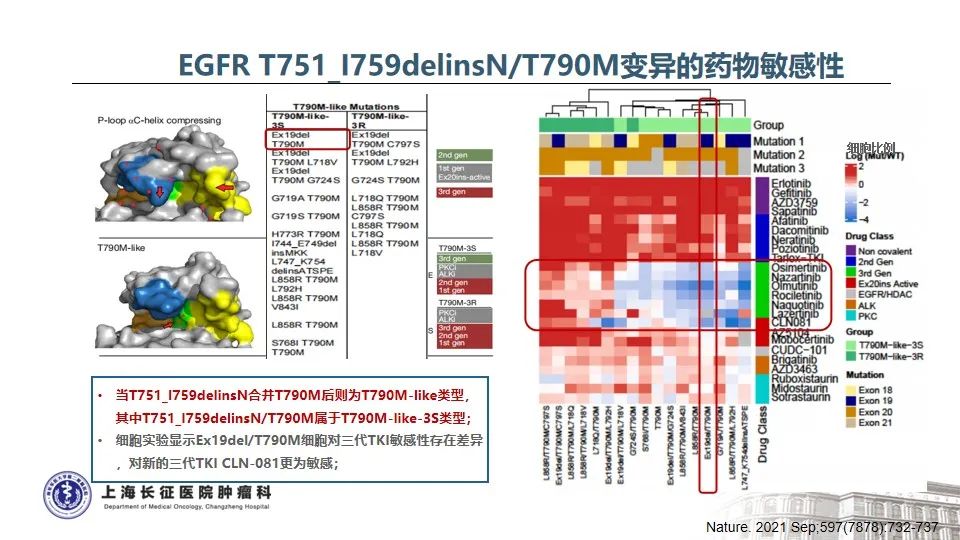
随着分子检测手段的日益精准,越来越多的EGFR突变被发现,由此也证实EGFR突变的NSCLC是一类异质性极强的疾病25。以EGFR外显子19缺失为例,突变类型超过50种,包括单纯的氨基酸缺失、缺失合并点突变、缺失并插入等。本例患者所测得的EGFR T751_I759delinsN变异属于19delins突变,在肺癌中仅占0.13%。该变异位于EGFR蛋白激酶结构域的C-helix,能通过改变C-helix的位置激活激酶,从而影响TKI治疗的敏感性26。既往研究发现,与经典的EGFR 19del(如E746_A750del)相比,罕见的EGFR 19delins突变患者有着更优的预后,一线接受EGFR TKI治疗的PFS时间显著延长27。一例65岁女性肺腺癌患者检出EGFR T751_I759delinsN,使用埃克替尼治疗,最佳疗效为PR,PFS长达22个月28。这与本例患者一线从易瑞沙中获得接近26个月的PFS时间也是一致的。
目前研究证实,当患者一代TKI耐药进展后,无论是常见的EGFR 19del变异,还是罕见的EGFR 19delins变异,T790M突变均是主要的耐药机制。当出现T790M耐药突变后,与经典19del相比,19delins罕见变异患者二线接受奥希替尼的PFS显著缩短(5.0m vs 12.0m, p<0.0001,L747_A750delinsP除外)27。
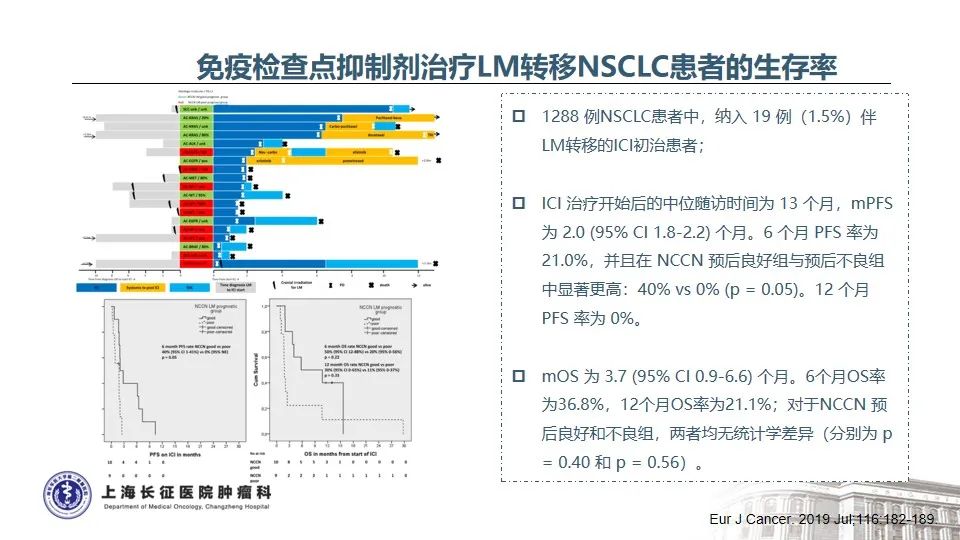
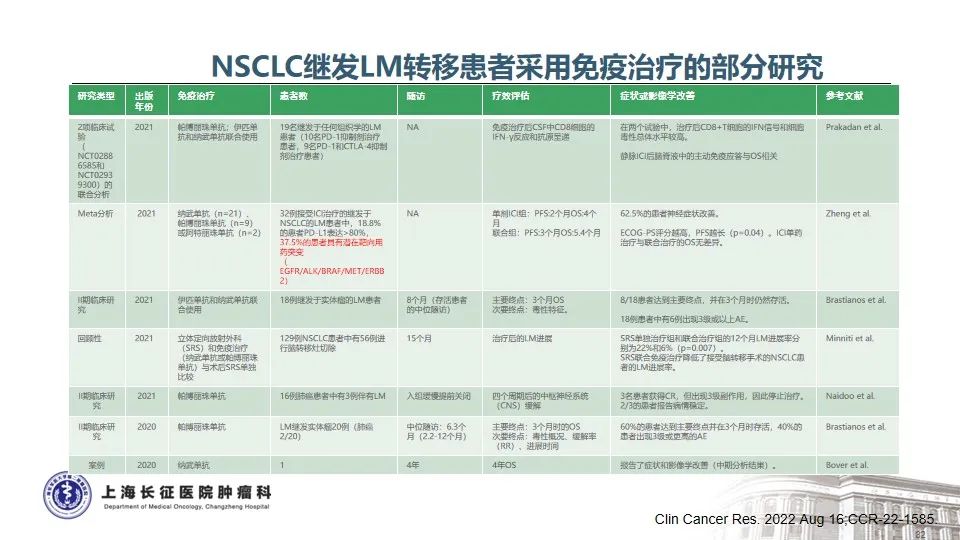
2. EGFR TKI耐药的晚期NSCLC患者或将从免疫治疗中获益
随着对靶向药物免疫调节作用的深入认识及临床证据的不断生成,免疫治疗有望为驱动基因阳性非小细胞肺癌带来新希望28。多项临床研究探索了不同模式的免疫治疗方案,为耐药EGFR突变NSCLC患者的免疫治疗提供了有效的证据和指导:
1) 免疫联合化疗和抗血管生成治疗:IMpower150研究29和ORIENT-31研究30分别探索了EGFR-TKIs治疗失败的NSCLC患者接受不同的免疫联合化疗和抗血管生成治疗的有效性和安全性,两项研究一致地证实该联合治疗策略的有效性,显著延长了患者的总生存期,而四药联合的严重不良反应也明显高于三药联合组和单纯化疗对照组。
2) 免疫联合化疗:BGB-A317-2001-IIT研究31、CT18研究32以及帕博利珠单抗联合培美曲塞和卡铂的研究均证实:既往接受过TKIs治疗的EGFR突变或ALK融合NSCLC患者,ICIs联合化疗用于耐药EGFR突变NSCLC的治疗具有良好的疗效与安全性。
3) 免疫联合抗血管治疗:一项卡瑞利珠单抗联合阿帕替尼治疗至少接受过两种系统性治疗后疾病进展的驱动基因阳性NSCLC的临床研究显示,43例患者的ORR为18.6%,中位PFS为2.8个月,且PD-L1阳性患者比阴性患者的ORR更佳(分别为27.3%和7.7%)34。
4) 免疫单药治疗:ATLANTIC研究结果提示,对于EGFR/ALK-TKIs耐药的PD-L1阳性患者来说,ICIs单药治疗也可能是一种有效选择。
综上,越来越多的证据表明,驱动基因阳性的NSCLC靶向治疗进展后仍可用从免疫治疗中获益,然而采取何种联合方案将是下一步探索的重要问题。
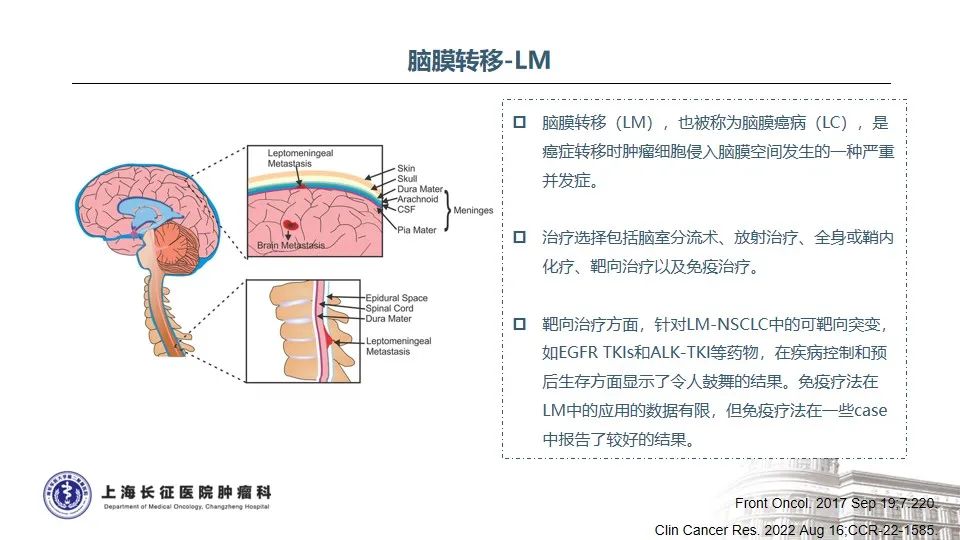
3. 肺癌脑膜转移治疗进展梳理
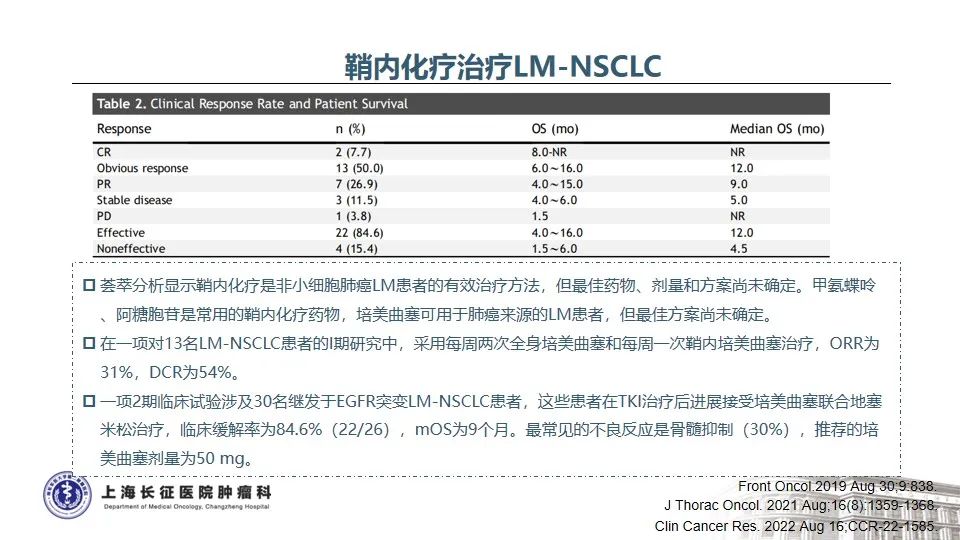
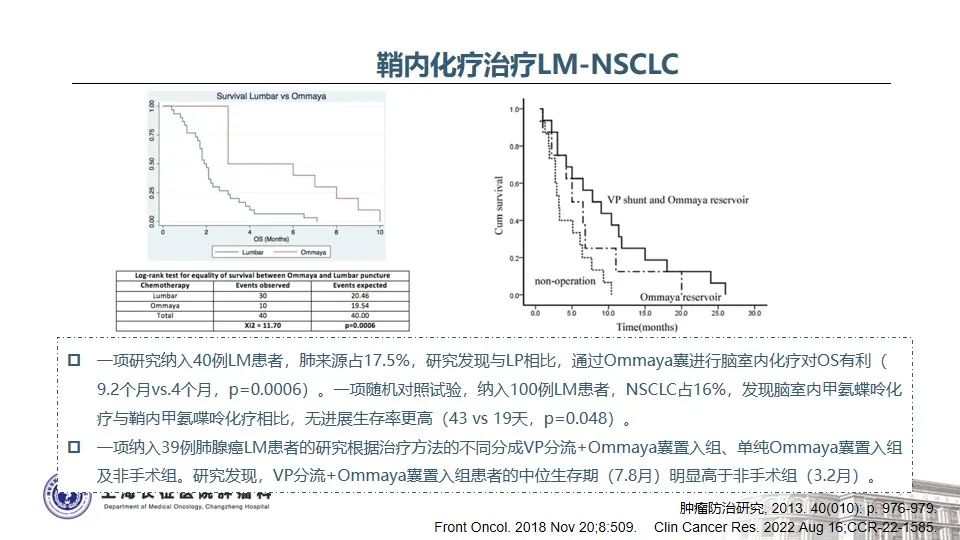
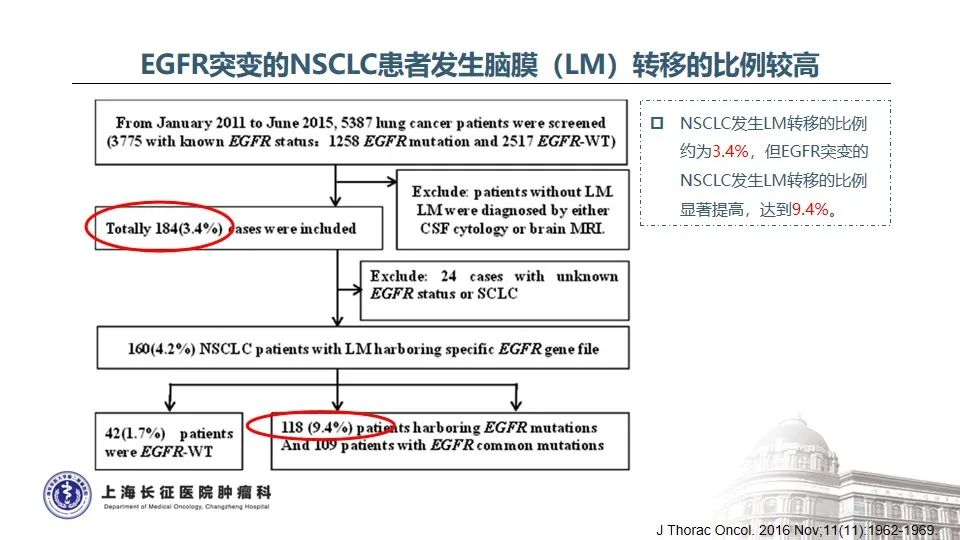
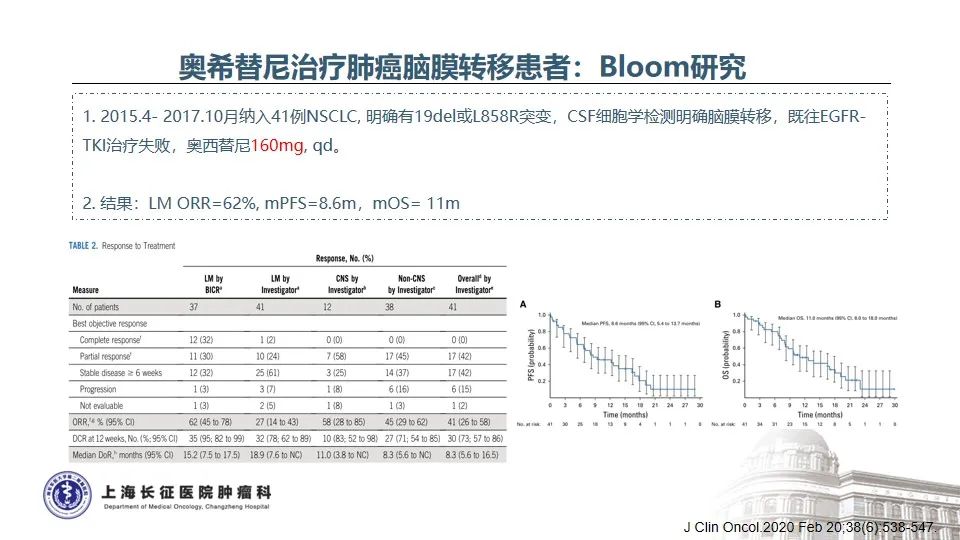
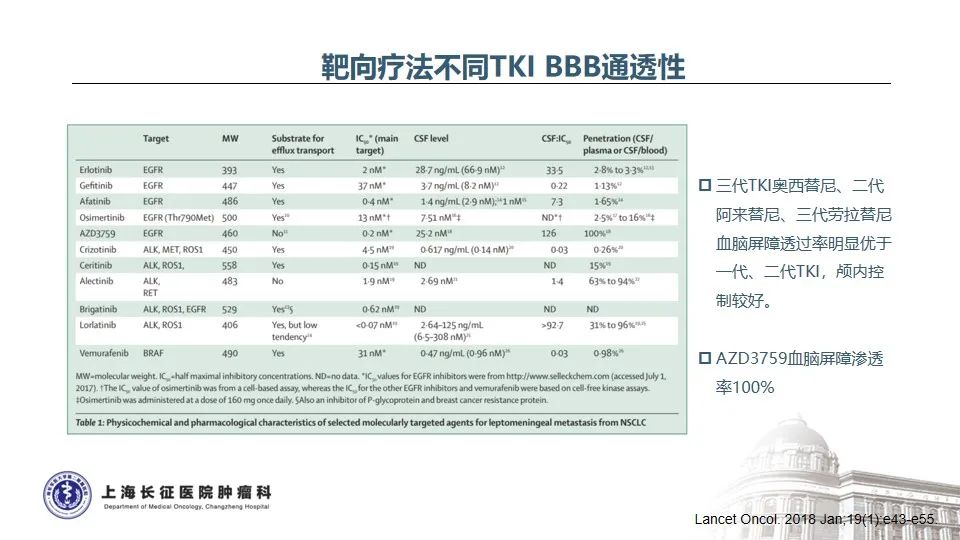
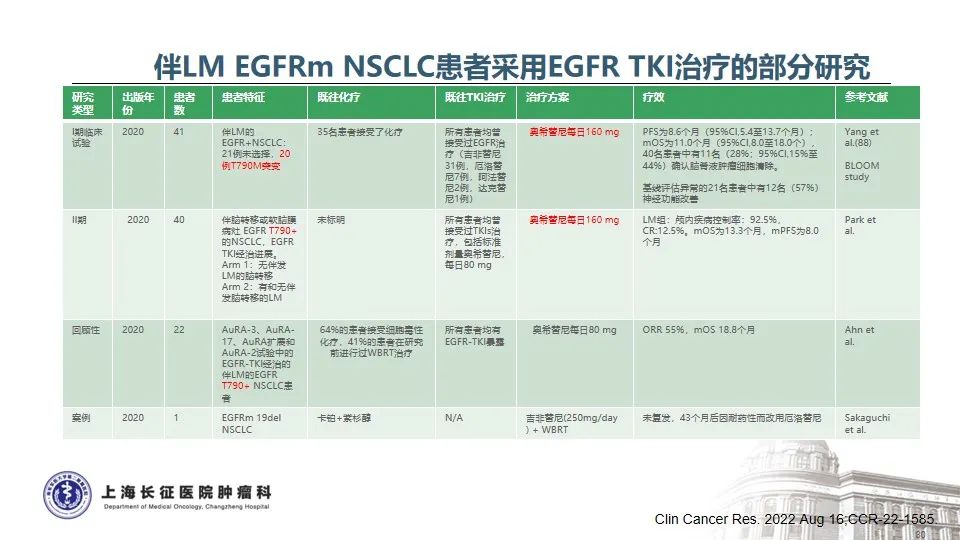
NSCLC中发生脑膜转移的比例约3.4%,而EGFR突变的NSCLC发生脑膜转移比例显著增高,高达9.4%35。目前NCCN指南推荐,EGFR TKIs治疗耐药后如果发生寡进展或中枢神经系统病灶进展,可以继续应用原EGFR TKIs治疗并联合局部治疗。在不同EGFR TKIs选择方面,不同EGFR TKIs对血脑屏障的透过性不同,三代奥希替尼显著高于一代或二代TKI,因此对颅内病灶控制效果更好36。BLOOM研究证实,对于既往EGFR TKI治疗进展出现脑膜转移的NSCLC患者,接受奥希替尼160mg每天治疗后,神经放射学家评估的ORR为62%,治疗持续时间为15.2个月,脑脊液中肿瘤细胞的清除率为28%,患者的神经功能显著改善37。而对于驱动基因阴性的患者,鞘内注射或通过Ommaya囊给予包括培美曲塞在内的系统化疗是行之有效的选择38-40。另外,澳大利亚多中心的回顾性真实世界研究也发现,IMpower150 ABCP四药联合方案在驱动基因阳性靶向治疗后、CNS转移的患者中显示出良好的临床疗效,脑转移和脑膜转移的患者总生存期分别是11.4个月和7.1个月41。
临床团队分析和方案选择及评价(临床专家焦晓栋教授):
由于患者颅内病灶导致严重的神经系统异常,常规化疗和大分子单抗药物的脑膜通透性不佳,因此后续优先考虑尝试对颅内病灶控制良好的EGFR TKI。目前,中国临床可及的三代EGFR TKI包括奥希替尼、阿美替尼和伏美替尼,三者对CNS转移病灶的有效性不同,其中伏美替尼在2021年WCLC大会公布的剂量拓展研究显示,伏美替尼160mg组的CNS ORR高达84.6%,CNS DCR为100%,显著高于奥希替尼和阿美替尼既往报道的数据。因此患者入院后及时给予伏美替尼160mg/天口服,并于2022-8-22日行Ommaya囊置入术,31日行培美曲塞50mg经Ommaya囊注射。但患者由于一般状况急剧恶化,于9月2日去世。
臧教授总结:
1. EGFR 19delins罕见突变在临床中应予以重视
既往对于发生在EGFR 19外显子的缺失突变临床上缺乏足够认识,通过文献梳理,我们发现与传统EGFR 19del突变相比,19delins是一类相对特殊、罕见的类型,其对一代EGFR TKI的响应更为持久,当发生T790M突变时,不同的EGFR 19delins突变对奥希替尼的敏感性不同。
2. 耐药的EGFR突变患者或将从免疫治疗中获益
临床前研究显示,EGFR TKI在抑制EGFR信号通路激活的同时,也能通过多种途径调节肿瘤免疫微环境,诱导抗肿瘤免疫反应。多项研究探索了不同免疫联合方式在EGFR耐药患者中的疗效和安全性,如免疫联合抗血管生成药物和化疗模式、免疫联合化疗模式、免疫单药等。对于EGFR TKI耐药进展的患者,在缺乏有效靶向药物治疗的情况下,推荐使用免疫治疗,但具体采用何种治疗方案,需结合患者的体能状态和疾病进展情况综合判断。
案例二详情:













右滑查看更多
会议总结:本次MTB研讨会共讨论了两个值得临床思考的案例,案例一为一例HER2伴KRAS基因突变的结直肠癌患者,一线免疫联合抗血管生成药物治疗持久地遏制肿瘤的生长,后结合患者的实际情况不断微调治疗方案,以期通过MTB讨论积极为患者寻求更为有效的后续治疗方案;案例二是一个教学相长的病例,一携带EGFR 19delins罕见突变的肺癌患者,经两线TKI治疗出现脑膜转移,尽管目前对于脑膜转移的肺癌患者后线治疗的证据有限,但通过大量文献复习和深入讨论也体现了长征医院疑难肿瘤MTB团队的仁爱和匠心。

参考文献
1.Tebbutt N, Pedersen MW, Johns TG. Nat Rev Cancer. 2013 Sep;13(9):663-73.
2.Arteaga CL, Engelman JA. Cancer Cell. 2014 Mar 17;25(3):282-303.
3.JAMA Oncol. 2022 Mar 3.
4.Lancet Oncol. 2019;20(4):518-530.
5.Nat Med. 2021; 27(11): 1899–1903;
6.Clin Colorectal Cancer. 2020 Dec;19(4):256-262.e2.
7.Lancet Oncol. 2016 Jun;17(6):738-746.
8.J Clin Oncol . 2018 Feb 20;36(6):536-542.
9.Nature. 2018 Feb 8; 554(7691): 189–194.
10.Clin Cancer Res. 2008 Apr 15;14(8):2465-75.
11.Cancer Discov 2020;10: 1–14
12.J Clin Oncol. 2012 Oct 10;30(29):3570-7.
13.Cancer Discov. 2022 Apr 1; 12(4): 924–937.
14.J Cancer Res Clin Oncol. 2022 Apr 19.
15.Cancer Sci. 2021 Jan;112(1):314-322.
16.Oncotarget. 2017 Jan 10; 8(2): 3237–3245.
17.Case Rep Oncol. 2015 Jan-Apr; 8(1): 83–87.
18.J Clin Oncol. 2020 Jun 20;38(18):2053-2061
19.Clin Cancer Res. 2021 Apr 15;27(8):2139-2147.
20.Cell Rep Med. 2021 Aug 27;2(9):100383.
21. 2020 ESMO LBA41
22.Front Oncol. 2020 Nov 12;10:594125.
23.Front Oncol. 2021 Oct 6;11:754881.
24.JAMA Oncol. 2020 Jun 1;6(6):831-838.
25.J Thorac Oncol. 2017 Apr;12(4):612-623.
26.Lancet Oncol. 2012 Jan;13(1):e23-31.
27.Eur J Cancer. 2020 Dec;141:199-208.
28.晚期驱动基因阳性非小细胞肺癌免疫治疗专家共识(2022版)[J]. 中华肿瘤杂志, 2022, 44(10):1047-1065.
29. J Thorac Oncol. 2022 Feb;17(2):309-323.
30.Lancet Oncol. 2022 Sep;23(9):1167-1179.
31. BH Han, et al. 2021 ESMO-IO. P148.
32.Signal Transduct Target Ther. 2021 Oct 15;6(1):355.
33. WCLC 2021,OA 09.03
34.Transl Lung Cancer Res. 2022 Jun;11(6):964-974.
35.J Thorac Oncol. 2016 Nov;11(11):1962-1969.
36.Lancet Oncol. 2018 Jan;19(1):e43-e55
37.J Clin Oncol.2020 Feb 20;38(6):538-547.
38.Front Oncol.2019 Aug 30;9:838.
39.J Thorac Oncol. 2021 Aug;16(8):1359-1368.
40.Clin Cancer Res. 2022 Aug 16;CCR-22-1585.
41.Clin Lung Cancer. 2022 Aug 7;S1525-7304(22)00168-1.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言