Cancer Cell:陆军军医大学朱波等揭示了骨转移肿瘤对免疫检查点疗法耐药的新机制!
2025-04-29 iNature iNature 发表于陕西省
该研究表明骨转移通过产生骨桥蛋白的破骨细胞减少对关卡阻断免疫疗法的骨外反应。
骨转移病灶通常与对免疫检查点封闭(ICB)疗法的次优反应有关。
2025年4月24日,陆军军医大学朱波、贾罄竹、新加坡国立大学Qijing Li共同通讯在Cancer Cell在线发表题为“Bone metastases diminish extraosseous response to checkpoint blockade immunotherapy through osteopontin-producing osteoclasts”的研究论文,该研究表明骨转移通过产生骨桥蛋白的破骨细胞减少对关卡阻断免疫疗法的骨外反应。

免疫检查点阻断(ICB)疗法的治疗进展已经显著改善了癌症免疫治疗,特别是对于实体瘤。然而,长期生存益处仍然局限于少数患者。识别机械驱动的生物标志物以预测患者预后一直是该领域的重点,并生成了几种预后生物标志物以反映肿瘤内在耐药性,肿瘤类型特异性或突变特异性肿瘤免疫微环境(TIME)或合并症的全身影响。然而,即使在生物标志物分层的患者人群中,大多数基于原发肿瘤分析,对ICB治疗的反应性通常仍不令人满意。因此,癌症治疗应该从只关注原发性肿瘤转移到将身体视为一个完整的免疫系统。
最近的进展是认识到肿瘤转移的器官显著影响ICB治疗的结果。肿瘤细胞主动适应不同器官的微环境,导致恶性表型和治疗反应的异质性。例如,肝转移更具侵袭性,对治疗更具抗性,而淋巴结转移通常对ICB表现出更强的反应。专注于器官转移相关影响的研究为造成ICB治疗反应差异的免疫相关机制提供了见解。因此,器官特异性调节的概念在癌症免疫学领域越来越受到重视,尤其是当它与ICB免疫疗法相关时。
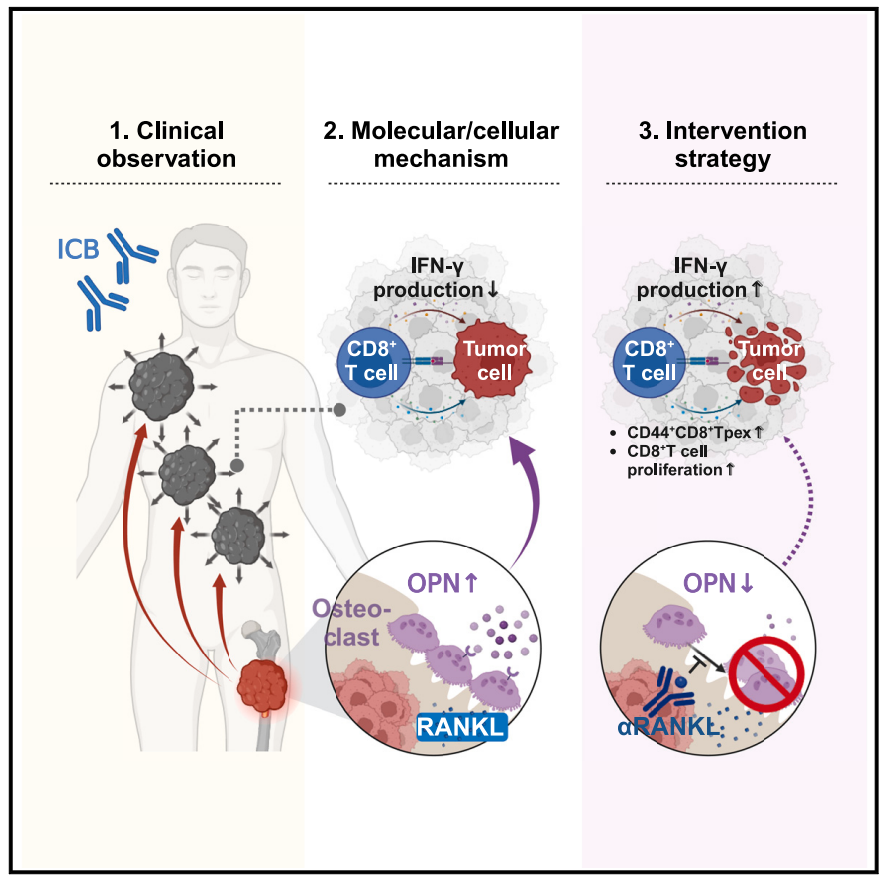
机理模式图(图源自Cancer Cell)
骨是转移的常见部位,特别是在乳腺癌、前列腺癌和肺癌中。临床试验已经将骨转移与ICB治疗患者的不良临床结果联系起来。几项研究已经表征了骨转移病灶中独特的肿瘤微环境(TME)。具体而言,骨吸收过程中释放的TGF-b抑制Th1分化,同时促进Th17极化,有助于ICB耐药性。骨转移富含产生CCL20的炎性单核细胞,这会损害CD8+ T细胞功能。研究表明,破坏CCL20-CCR6轴可以减少T细胞衰竭,延长ICB治疗后的生存期。值得注意的是,最近的研究表明,骨外肿瘤和骨转移瘤可能会改变骨中的造血功能,有利于免疫耐受,从而将骨免疫相互作用的范围扩大到骨外部位。
在这项研究中,研究人员观察到,在多个临床队列和各种小鼠模型中,骨转移的存在诱导了骨外肿瘤的ICB耐药。从机制上讲,这种长距离通讯是由产生骨桥蛋白的骨肿瘤条件破骨细胞介导的(OPN)。通过循环,OPN重编程骨外肿瘤微环境,并损害CD8+ TCF1+前体细胞的T细胞募集和分化,CD8+ TCF1+前体细胞是ICB疗效的必要群体。在小鼠中,ICB反应性通过αRANKL阻断破骨细胞生成、中和循环中的OPN或破骨细胞中OPN的组织特异性消除而恢复。αRANKL-ICB联合方案的作用模式和治疗效果在临床队列中得到验证。这些发现证实了骨是被肿瘤转移利用的特异性免疫调节器官,并提示破骨细胞形成是改善骨转移患者ICB预后的有希望的靶点。
参考信息:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(25)00137-0#au27
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#骨转移# #免疫检查点阻断#
14