Nat Commun:河南大学许志祥等团队研究发现高迁移率蛋白A1通过抑制STING介导的抗肿瘤免疫促进食管鳞状细胞癌进展
2025-06-08 iNature iNature 发表于上海
研究表明HMGA1抑制干扰素基因的刺激物(STING),抑制I型干扰素分泌,下调干扰素刺激的基因,并损害肿瘤浸润淋巴细胞(TIL)募集。
食管鳞状细胞癌(ESCC)是一种常见的侵袭性癌症,对免疫治疗的反应有限。高迁移率蛋白A1(HMGA1)是一种染色质重塑蛋白,在肿瘤进展中起关键作用,但其对ESCC抗肿瘤免疫的影响仍不清楚。
2025年6月2日,河南大学生命科学学院许志祥、Jian Yongping、浙江大学医学院崔儒涛共同通讯在Nature Communications上在线发表题为“High mobility group A1 (HMGA1) promotes esophageal squamous cell carcinoma progression by inhibiting STING-mediated anti-tumor immunity”的研究论文。研究表明HMGA1抑制干扰素基因的刺激物(STING),抑制I型干扰素分泌,下调干扰素刺激的基因,并损害肿瘤浸润淋巴细胞(TIL)募集。
HMGA1通过与共激活因子CBP/p300竞争结合CREB来抑制STING转录。来自具有HMGA1和STING表达改变的转基因小鼠模型的ESCC表现出不同的TIL水平和对STING激动剂的敏感性。此外,研究设计合成了一系列HMGA1抑制剂,包括一种基于苝的纳米颗粒PDIC-DPC,可有效抑制HMGA1并增强TIL浸润。综上所述,研究结果将HMGA1确定为ESCC中的关键免疫检查点,并表明靶向HMGA1可以改善免疫治疗结果。

食管癌(ESCA)包括食管鳞状细胞癌(ESCC)和食管腺癌(EAC),是最常见的胃肠道恶性肿瘤之一。ESCC患者在诊断时通常表现为晚期疾病,导致通常预后不良。尽管针对各种癌症的靶向治疗和免疫治疗取得了重大进展,但这些治疗ESCA的进展相对较慢。在过去十年中,只有两种针对晚期EAC的靶向疗法出现,而ESCC靶向治疗的进展微乎其微。虽然与EAC相比,ESCC可能更适合基于免疫的疗法,目前免疫检查点抑制剂的有效性仍无定论。这些药物正在临床试验中对ESCC的各个阶段进行测试,但仍有待明确结果。因此,确定新的免疫治疗靶点和策略对于改善ESCC患者的预后至关重要。
高迁移率蛋白A1(HMGA1)是一种结构转录因子,在染色质重塑中起关键作用。它与DNA小沟中富含AT的区域结合,诱导DNA弯曲,从而促进转录因子的结合并调节基因表达。这种对染色质动力学的参与使HMGA1能够参与各种细胞功能和过程。值得注意的是,HMGA1通常在癌细胞中过表达,并且与多种癌症类型的不良预后有关。
干扰素基因刺激因子(STING)是先天免疫反应的关键组成部分,也是癌症免疫治疗的有前途的靶点。STING由环状GMP-AMP合酶(cGAS)激活,该合酶可检测来自病原体或受损宿主细胞的双链DNA。识别后,cGAS产生第二个信使cGAMP,它激活STING并促进其从内质网转位到高尔基体。然后,激活的STING通过磷酸化募集并激活TANK结合激酶1(TBK1)。这进而导致干扰素调节因子3(IRF3)的募集,而IRF3被STING和TBK磷酸化。磷酸化的IRF3二聚化并进入细胞核,从而驱动I型干扰素(T1IFNs)和干扰素刺激基因(ISGs)的转录。干扰素(IFN)的分泌和ISGs的表达增强了CD8+ T细胞的活化和募集,从而启动和促进抗肿瘤免疫。研究表明,STING激活可传播癌症免疫周期,重塑肿瘤微环境,最终有助于肿瘤细胞的清除,这使得STING激动剂成为一种有前景的癌症治疗策略。尽管如此,它们对某些患者的疗效可能有限。
在这项工作中,研究者表明HMGA1的耗竭导致先天免疫信号因子和cGAS/STING通路中几个关键成分的上调。HMGA1干扰增加STING的转录,增强IFN的分泌,刺激ISGs的表达,从而促进肿瘤微环境中的T细胞浸润。这种效应在免疫缺陷小鼠中被抵消,突出了免疫系统在此过程中的作用。值得注意的是,在ESCC模型中,特别是Hmga1flox/floxK14 (HMGA1条条性敲除)和Hmga1KI/KIK14 (HMGA1条条性敲入)小鼠中,STING激动剂治疗表明,HMGA1过表达使肿瘤对这些激动剂的反应性降低。这表明HMGA1高表达的食管鳞状细胞癌可能对STING激动剂治疗耐药。此外,基于HMGA1的结合口袋,研究合成了一种HMGA1特异性抑制剂PDIC-DPC并进行了表征。该苝基纳米粒不仅抑制食管鳞癌细胞和原位食管鳞癌的肺转移,而且通过抑制HMGA1的表达增强T淋巴细胞浸润。综上所述,研究结果为食管鳞癌提供了一种治疗策略,包括抑制HMGA1上调STING并改善肿瘤微环境中的免疫细胞浸润。
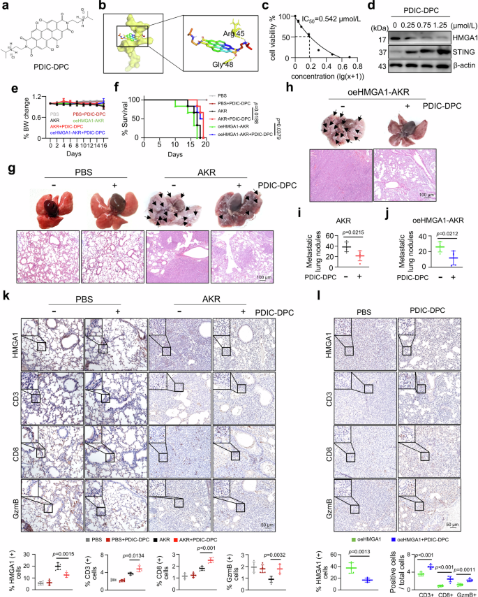
图1合成HMGA1抑制剂PDIC-DPC并鉴定其促进食管鳞癌及其转移灶中T淋巴细胞浸润的作用(摘自Nature Communications)
参考消息:
https://doi.org/10.1038/s41467-025-60221-6
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#食管鳞状细胞癌# #STING#
17 举报