中国科学技术大学姜洪源教授《Biomaterials》:细胞核作为独立的力学感受器可以感知空间约束并触发细胞的铺展和迁移
2025-04-29 BioMed科技 BioMed科技 发表于陕西省
中国科学技术大学姜洪源团队发现,空间限制使软粘性基质上静止圆形细胞铺展迁移,呈现刚性基质细胞表型。揭示细胞核感知拥挤,通过激活 YAP 调控 “从内到外” 的生物力学机制,为癌症治疗等提供新视角。
【研究内容】
体内细胞通常处于高度拥挤的三维微环境中,受到周围细胞和胞外基质(ECM)的空间约束。特别地是,在肿瘤转移、免疫反应、伤口愈合及胚胎发育等生理过程中细胞所面临的空间受限情况尤为严峻。这种由拥挤力学微环境引发的空间约束会显著影响细胞迁移行为,因此在受限空间内细胞展现出高度的迁移可塑性,即细胞能够根据灵活地切换迁移模式。例如,狭窄通道中的癌细胞可通过水和离子的定向输运进行迁移,而不依赖于细胞粘附[1]。2015年的2篇Cell论文和2020年的2篇Science论文发现,空间受限还能够促使低粘细胞发生间充质-阿米巴样表型转换[2-5]。目前的研究主要关注低粘甚至无粘环境下拥挤对细胞迁移行为的影响,但是体内大多数生理情况是可粘附的胞外微环境。事实上,在某些情况下,即使在无粘环境中细胞仍可主动分泌胞外基质蛋白(如胶原蛋白、纤连蛋白等)[6, 7],从而增强胞外环境的可粘附性。因此,在体内最常见的微环境——粘性和可变形的空间约束下,细胞如何感知拥挤的挑战,以及它们是否可以通过迁移逃离拥挤的微环境,仍然有待研究。
针对这一问题,中国科学技术大学姜洪源教授团队研究发现了空间限制使软粘性基质上最初静止的圆形细胞铺展和迁移,表现出与刚性基质上自由细胞相似的表型,揭示了这种空间限制诱导的细胞铺展和迁移广泛存在于许多细胞类型中,阐明了细胞核直接感知拥挤环境进而调控迁移转变的“从内到外”的生物力学机制。相关研究成果以" Mechanical confinement triggers spreading and migration of immobile cells by deforming nucleus "为题于2025年2月25日发表在《Biomaterials》期刊上。
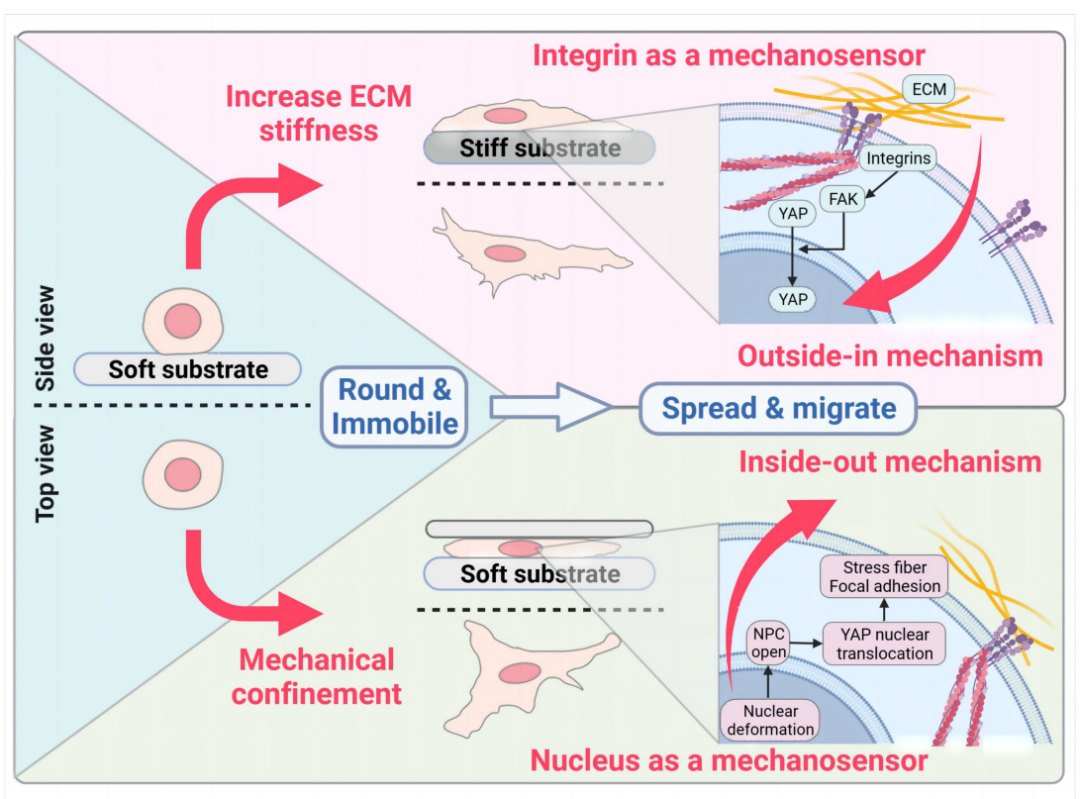
图1.空间受限通过依赖于细胞核的“从内到外”机制调控细胞迁移转变。
研究团队设计了空间受限实验装置,实现了空间受限高度和基底刚度的解耦。实验表明,软基底上细胞在施加空间受限后,其铺展面积增大(图2A-C)、伪足数目增加(图2D)、细胞骨架发生极化(图2E)。软基底上细胞在受限后形成更加成熟的黏着斑(图2F-G),而且迁移速度提升近8倍(图2H-J)。值得注意的是,受限介导的细胞铺展、粘附和迁移表型与刚性基质上自由细胞的表型高度相似(图2C-J)。这些发现揭示空间受限本身足以在软基质上重构细胞力学行为,其效应跨越细胞粘附、骨架重组到迁移模式等多个层面,且广泛存在于如上皮(MDCK)、间质(3T3)、肿瘤(HepG2)等多种类型细胞中。
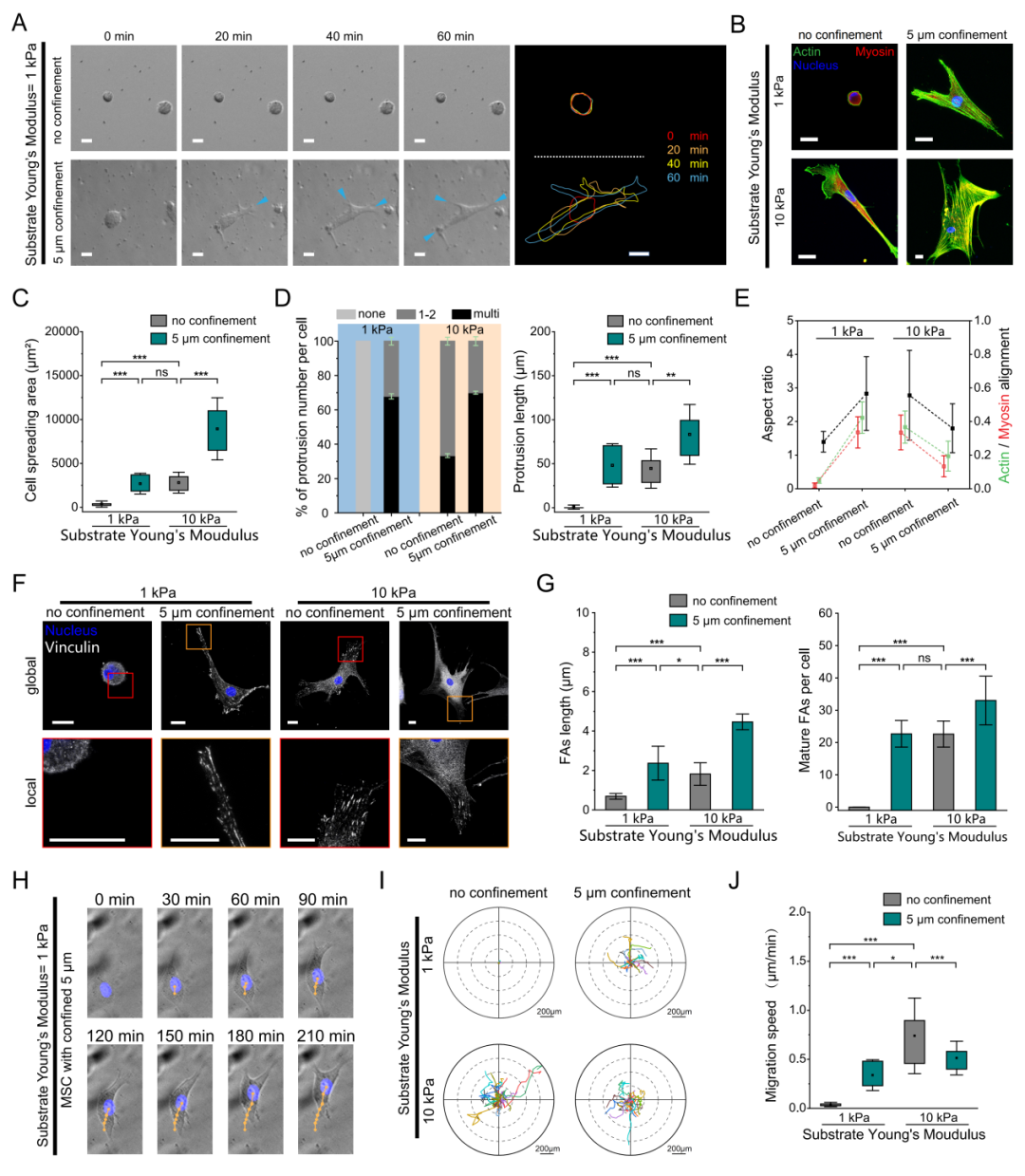
图2. 空间受限促使软基底上静止的圆形细胞呈现出类似非受限硬基底上细胞的铺展、粘附和迁移。
进一步研究发现,使用formin抑制剂SMIFH2能够完全阻遏细胞伪足铺展(图3A,3C),并显著抑制迁移(图3D),然而抑制Arp2/3复合体几乎不影响伪足伸展和迁移(图3A-D)。因此,在软基底上,空间约束诱导的细胞铺展和迁移主要依赖formin蛋白而非Arp2/3复合体。此外,myosin-II介导的细胞骨架收缩对受限诱导的迁移十分重要:抑制myosin-II或ROCK会使迁移速度降低65%(图3B-D)。上述实验结果表明,空间受限介导的细胞铺展和迁移依赖于Formin介导骨架重构和myosin-II介导骨架收缩。
考虑到细胞力学相关转录激活因子YAP已被广泛证实可调节细胞骨架重构和收缩,本研究进一步探讨了YAP在受限介导的细胞铺展和迁移中的作用。实验中发现软基底上YAP主要定位于胞质,但是受限后则呈现类似硬基底上的核定位(图3E)。这表明空间受限本身即可激活YAP核定位。干扰YAP的表达能够完全阻遏受限介导的软基底上细胞的铺展与迁移(图3F)。此外,采用小分子抑制剂verteporfin(破坏YAP-TEAD复合体阻断转录),受限细胞重新恢复圆形静止状态,同时应力纤维极化、伪足伸展及肌球蛋白介导的黏着斑均消失(图3G)。这些证据共同表明,受限诱导的细胞表型重塑不仅依赖于YAP核转位,更需通过YAP-TEAD相互作用启动下游转录。
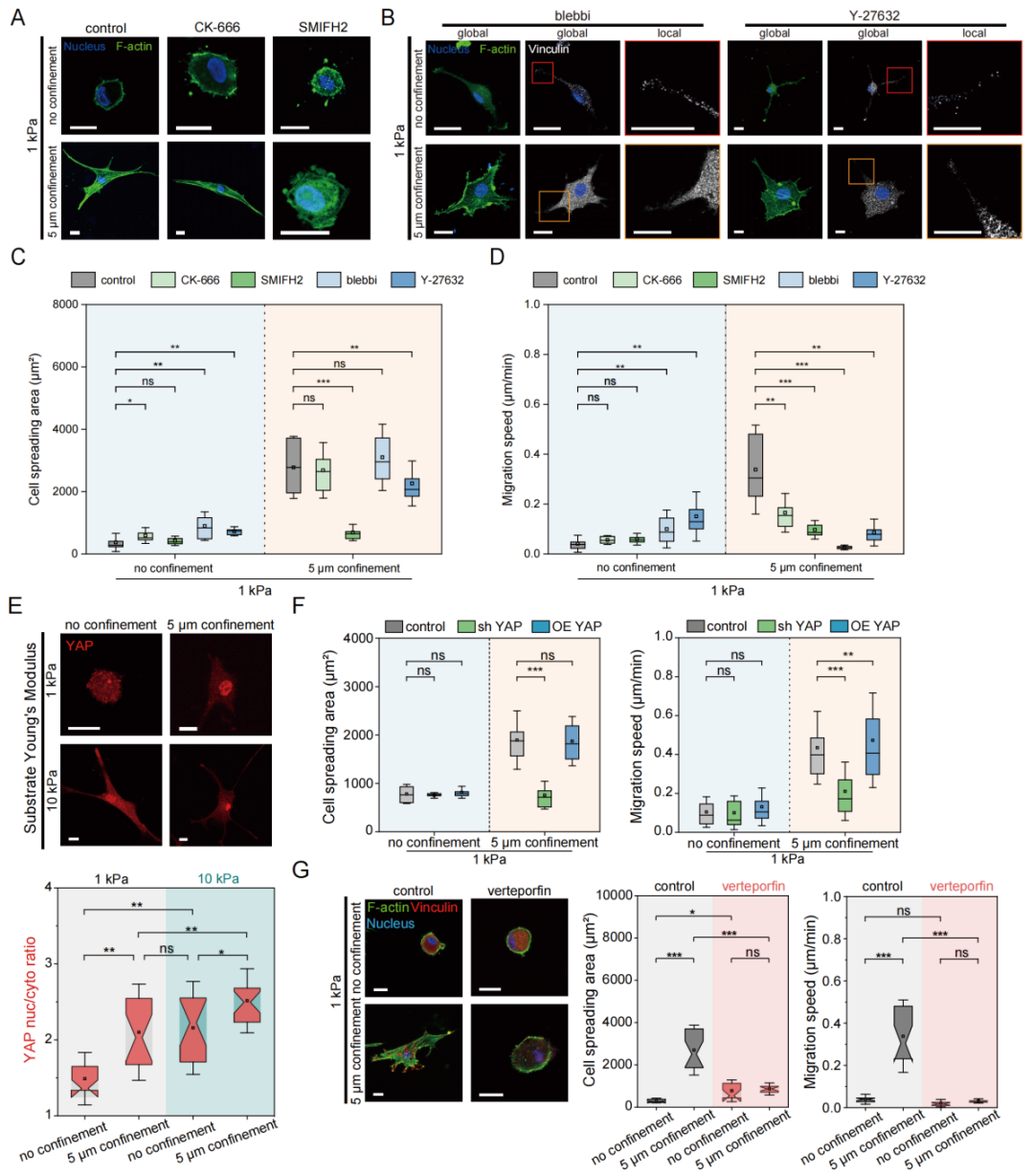
图3.空间受限介导的细胞表型转变依赖于YAP核定位及其介导的细胞骨架重构和收缩。
实验中观察到空间约束下YAP核定位(20分钟)显著早于黏着斑组装(60分钟)(图4A-B)。通过myosin-II抑制剂(20 µM Blebbistatin/15 µM Y-27632)与integrin阻断剂(10 mg/mL P5D2)干预实验同样证实,受限诱导的YAP核转位均不受myosin-II收缩或黏着斑影响(图4C-D)。这表明受限介导的YAP核定位并非依赖于经典的整合素粘附依赖的力学信号转导,而是存在新型力学感知机制。
为了探究受限介导YAP核定位的内在机制,对软基底上细胞施加不同受限高度并观察其响应。当受限高度低于细胞核自然高度阈值(7-10 µm)时,细胞核开始显著变形,并且出现YAP核定位。量化可知YAP核质比与核扁平化程度呈强正相关(图4E-F),表明核变形可能是YAP信号激活的直接驱动原因。
有趣的是,使用原子力显微镜探针直接对细胞核施加力学压载就可以触发细胞的铺展、粘附和迁移,但是压缩细胞质则没有作用(图4G)。敲降核纤层蛋白Lamin A/C降低核膜张力后,受限诱导的YAP核定位效率下降62%(图4H)。此外,通过紫杉醇抑制细胞分裂通过核内DNA翻倍来增大细胞核膜张力(核体积增大35%),发现YAP核定位的受限高度阈值从7 μm提升至10 μm(图4I)。这些证据证实空间受限是通过细胞核变形介导核膜张力升高调控YAP核定位,进而激活细胞骨架重构,从而调节细胞表型转换。
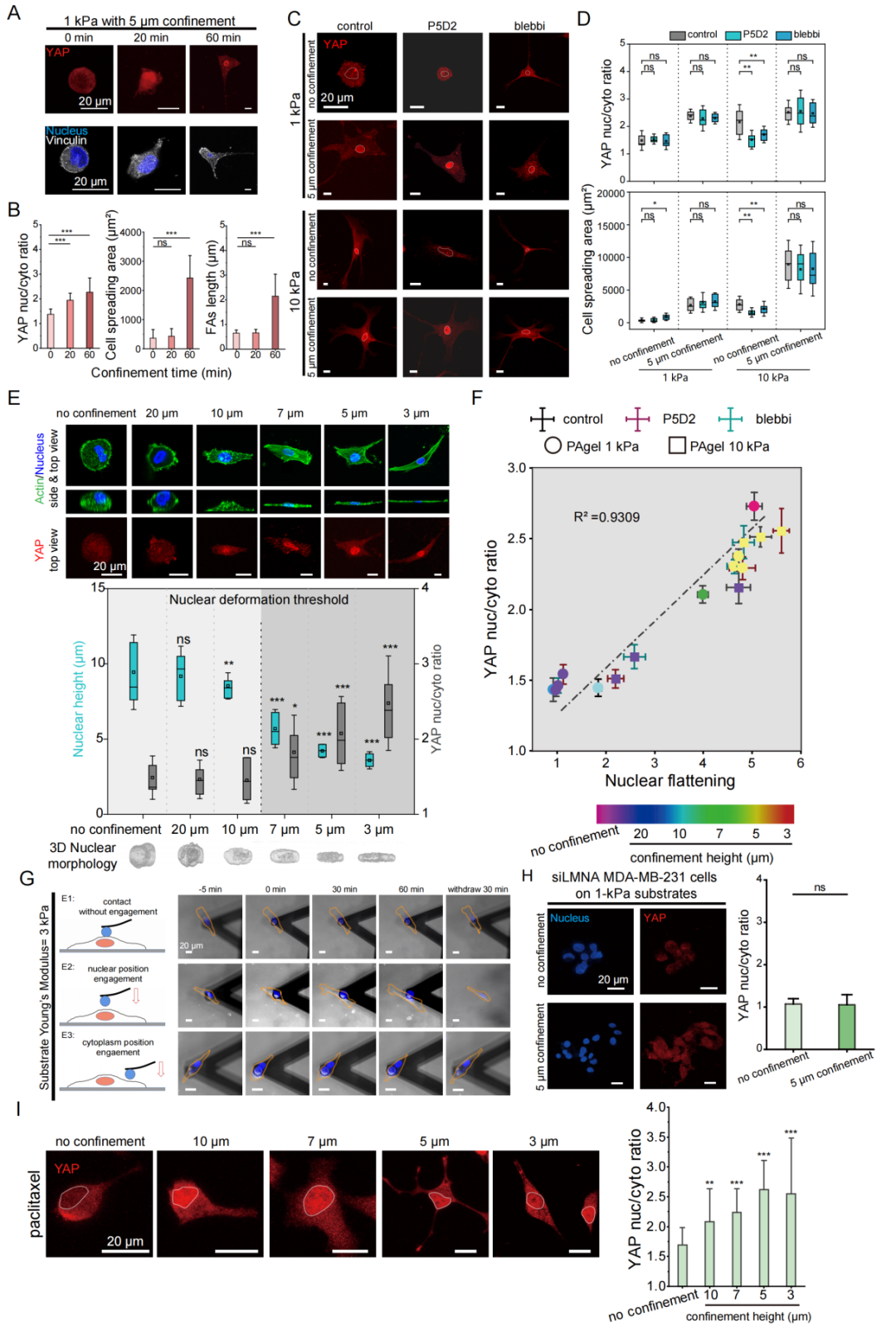
图4.细胞核可以作为独立的力学感受器直接感知空间受限并介导YAP核定位和细胞表型转换,而非依赖于细胞-基底间粘附。
【研究意义与未来展望】
传统观点认为,细胞在二维软基底上呈圆形且无法移动,但本研究发现,当存在细胞-ECM黏附时,空间受限会触发快速的间充质类型迁移(而非阿米巴虫类型迁移),表现为黏着斑、应力纤维和富含肌动蛋白的伪足形成。本研究提出一种“由内而外”的新机制:细胞核作为独立力学传感器,通过核扁平化直接感知空间受限,激活YAP入核,进而促进formin/myosin-II表达、黏着斑组装及细胞迁移。这种依赖于细胞核感知的“由内而外”的力学转导机制,与经典的“由外而内”机制(通过黏着斑-细胞骨架-细胞核传递力信号)截然不同。本研究发现,在黏附性微环境中,空间受限可以一定程度上“欺骗”或“误导”细胞对基底刚度的感知,即软基底上的细胞在受限后也可呈现类似硬基底上的表型。这一发现解释了体内柔软组织(如脑或乳腺)中细胞在拥挤力学微环境中的迁移现象,并为癌症转移、免疫反应等过程提供了新视角。例如,肿瘤内部因细胞过度增殖形成拥挤力学微环境,这种空间受限可能独立于ECM刚度激活癌细胞迁移,促进肿瘤侵袭。因而,靶向肿瘤力学微环境(如抑制YAP通路或核机械传感)可作为潜在临床治疗策略。总之,本研究阐明了拥挤力学微环境对细胞行为的调控作用,揭示了细胞核作为力学信号传导的重要角色,同时为开发针对肿瘤力学微环境的治疗手段奠定了科学基础。
中国科学技术大学饶冉博士和杨皓翔博士后为该论文的共同第一作者,姜洪源教授为通讯作者。该项研究得到了国家自然科学基金,中央高校基本科研业务专项基金,中国科学技术大学“双一流”建设研究基金以及科大新医学联合基金等项目的支持。研究工作得到了武汉纺织大学吕永刚教授以及中国科学技术大学微米纳米研究与制造中心的支持和帮助。
【课题组简介】
中国科学技术大学姜洪源教授:中国科学技术大学讲席教授、博士生导师,微尺度国家研究中心Bio-X交叉科学研究部双聘教授,“国家杰出青年基金”获得者、基金委“优秀青年基金”获得者、国家高层次人才计划入选者。围绕着生物力学和力学生物学开展了一系列工作,特别关注力学、物理学、生物学和临床医学等交叉领域内的一系列问题,例如细胞迁移和细胞分裂、动物细胞体积和压力的调控机制、力学微环境对恶性肿瘤生长和转移的调控机制、基于干细胞工程的组织器官修复替代等问题。作为第一/通讯作者,先后在Cell,Nature Biomedical Engineering,Phys. Rev. Lett.,Phys. Rev. X,Nature Communications,Biomaterials,ACS Nano等国内外主流期刊。
中国科学技术大学博士后杨皓翔:毕业于中国科学技术大学(本硕博),博士后合作导师为姜洪源教授教授。长期从事有关细胞骨架动力学和力学信号转导机制的研究,先后以第一/共同第一作者身份在Nature Biomedical Engineering, Biomaterials等期刊发表学术论文。
论文信息:
Ran Rao#, Haoxiang Yang#, Kailong Qiu, Min Xu, Hao Liu, Jinghao Shen, Weihao Wang, Runjie Nie, Huan Chen and Hongyuan Jiang*. Mechanical Confinement Triggers Spreading and Migration of Immobile Cells by Deforming Nucleus. Biomaterials 2025, 320, 123209.
参考文献:
[1]K.M. Stroka, H. Jiang, S.H. Chen, Z. Tong, D. Wirtz, S.X. Sun, K. Konstantopoulos, Water permeation drives tumor cell migration in confined microenvironments, Cell 157 (3) (2014) 611–623.
[2]Y.J. Liu, M. Le Berre, F. Lautenschlaeger, P. Maiuri, A. Callan-Jones, M. Heuze, T. Takaki, R. Voituriez, M. Piel, Confinement and low adhesion induce fast amoeboid migration of slow mesenchymal cells, Cell 160 (4) (2015) 659–672.
[3]V. Ruprecht, S. Wieser, A. Callan-Jones, M. Smutny, H. Morita, K. Sako, V. Barone, M. Ritsch-Marte, M. Sixt, R. Voituriez, C.P. Heisenberg, Cortical contractility triggers a stochastic switch to fast amoeboid cell motility, Cell 160 (4) (2015) 673–685.
[4]V. Venturini, F. Pezzano, F. Catala Castro, H.M. Hakkinen, S. Jimenez-Delgado, M. Colomer-Rosell, M. Marro, Q. Tolosa-Ramon, S. Paz-Lopez, M.A. Valverde, J. Weghuber, P. Loza-Alvarez, M. Krieg, S. Wieser, V. Ruprecht, The nucleus measures shape changes for cellular proprioception to control dynamic cell behavior, Science 370 (6514) (2020).
[5]A.J. Lomakin, C.J. Cattin, D. Cuvelier, Z. Alraies, M. Molina, G. Nader, N. Srivastava, J.M. Garcia-Arcos, I.Y. Zhitnyak, A. Bhargava, M.K. Driscoll, E. S. Welf, R. Fiolka, R.J. Petrie, N. Manel, A.M. Lennon-Dum´enil, D.J. Müller, M. Piel, The nucleus acts as a ruler tailoring cell responses to spatial constraints, Science 370 (6514) (2020).
[6]J.M. Tse, G. Cheng, J.A. Tyrrell, S.A. Wilcox-Adelman, Y. Boucher, R.K. Jain, L. L. Munn, Mechanical compression drives cancer cells toward invasive phenotype, Proc. Natl. Acad. Sci. U. S. A. 109 (3) (2012) 911–916.
[7]A. Subramanian, L.F. Kanzaki, J.L. Galloway, T.F. Schilling, Mechanical force regulates tendon extracellular matrix organization and tenocyte morphogenesis through TGFbeta signaling, Elife 7 (2018).
原文链接:
https://www.sciencedirect.com/unsupported_browser
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#细胞迁移# #空间限制#
23