首次报道:阿贝西利联合紫杉醇对CDK4/6激活型实体瘤有一定疗效,但小心CCNE扩增/旁路激活
2025-03-01 苏州绘真医学 苏州绘真医学 发表于陕西省
研究确定了一个以旁路信号通路激活和/或CCNE扩增为特征的不良基因状态组,这对治疗反应和生存情况产生了负面影响。

细胞周期蛋白D依赖性激酶(CDK)的功能失调,尤其是CDK4/6,会通过异常的蛋白质磷酸化来驱动癌细胞增殖。这项开放标签、单臂的Ib/II期试验评估了CDK4/6抑制剂阿贝西利联合紫杉醇治疗CDK4/6激活型肿瘤的疗效。纳入了伴有CDK4/6通路异常的局部晚期或转移性实体瘤患者。基于Ib期试验结果,确定II期试验的推荐剂量为阿贝西利100 mg,每日两次,以及紫杉醇70 mg/m2,在第1、8和15天给药,每4周为一个周期。II期试验的主要终点是总缓解率(ORR)。次要终点包括临床获益率(CBR)、无进展生存期(PFS)、总生存期(OS)以及安全性。同时进行了基于组织的下一代测序(NGS)和探索性循环肿瘤DNA(ctDNA)分析。
在2021年2月至2022年4月期间,30名患者接受了阿贝西利/紫杉醇治疗(中位随访时间为15.7个月),其中27名患者纳入疗效分析。CDK4/6扩增(50%)和CCND1/3扩增(20%)是常见的激活突变。ORR为7.4%,有2例部分缓解,CBR为66.7%(18/27)。中位OS和中位PFS分别为9.9个月(95%CI 5.7-14.0个月)和3.5个月(95%CI 2.6-4.3个月)。3级不良事件(50%,共21起事件)主要为血液学方面的。基因分析发现了一个“不良基因状态”的亚组,其特征是关键信号通路(RAS、Wnt、PI3K和NOTCH)存在突变和/或CCNE扩增,这与更差的PFS相关。
阿贝西利和紫杉醇对CDK4/6激活型肿瘤显示出一定的临床获益。研究确定了一个以旁路信号通路激活和/或CCNE扩增为特征的不良基因状态组,这对治疗反应和生存情况产生了负面影响。未来需要对同质患者组进行研究来验证这些发现。
-
阿贝西利和紫杉醇的联合用药对CDK4/6激活型肿瘤显示出了一定程度的临床获益;
-
ORR为7.4%,CBR为66.7%;
-
不良基因状态的患者以CCNE扩增和/或旁路信号通路激活为特征。
研究背景
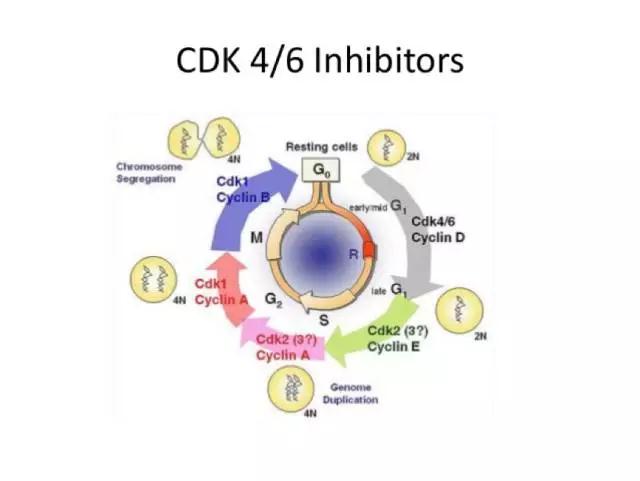
CDKs以及细胞周期蛋白,包括细胞周期蛋白D家族的CCND1、CCND2和CCND3,在人类癌症中常常被激活,它们通过推动细胞从G1期向S期转变来影响细胞周期进程。这些蛋白质与CDK4/6形成复合物,导致视网膜母细胞瘤(Rb)蛋白发生磷酸化,并激活E2F转录因子,进而促进DNA复制。在许多癌症中,CCND1/2/3或CDK4/6的扩增或过表达会加速这一过程,导致Rb蛋白过度磷酸化、检查点完整性缺失以及细胞不受控制地增殖。来自癌症基因组图谱的数据表明,在大约15%-30%的实体瘤中可观察到此类变异,同时还伴有其他与细胞周期相关基因(如CCNE1、CDKN2A、CDKN2B或Rb)的变化,这些实体瘤包括肉瘤、胶质母细胞瘤、黑色素瘤、生殖细胞肿瘤以及某些妇科癌症。
细胞周期蛋白D - CDK4/6通路的失调与多种癌症的预后不良和治疗耐药相关。然而,存在这些变异的肿瘤可能也会对CDK4/6抑制剂表现出更高的敏感性,这为靶向治疗提供了一种有前景的策略。由于细胞周期蛋白D和CDK在细胞周期机制中受到复杂的调控,因此靶向这些细胞周期蛋白已成为一种颇具吸引力的抑制肿瘤生长的方法。
为了实施这一策略,CDK4/6抑制剂,即阿贝西利、瑞波西利和哌柏西利,一直是研究最多且最成功的药物类别之一。阿贝西利是一种口服、选择性、ATP竞争性的CDK4/6抑制剂,在临床试验中已取得显著成效。在两项Ⅲ期试验中,对于HR + /HER2 -的乳腺癌患者,阿贝西利以每日两次、每次150 mg的剂量持续给药并联合内分泌治疗时,提高了OS和PFS,且安全性在可接受范围内。因此,美国FDA批准阿贝西利用于辅助治疗和姑息治疗。此外,一项正在进行的Ⅱ期篮子试验目前正在评估阿贝西利单药治疗CCND1/2/3或CDK4/6基因变异患者的疗效(NCT03310879)。
尽管CDK4/6抑制剂单药治疗已显示出抗肿瘤活性,但其缓解率仍然不高(<5%)。然而,CDK4/6抑制剂与靶向治疗药物或细胞毒性化疗药物联合使用有望产生协同效应。一项使用肺腺癌细胞进行的临床前研究表明,无论是否存在KRAS突变,CDK4/6抑制剂与紫杉醇联合使用均有协同效应,这提示该联合方案是一种潜在的治疗选择。紫杉醇已在包括肉瘤、乳腺癌、胃癌和前列腺癌等多种实体瘤中进行了研究,显示出其作为联合用药的潜力。近期的一项I期研究评估了CDK4/6抑制剂哌柏西利与紫杉醇联合用于乳腺癌患者的可行性和安全性。然而,尚无研究探索CDK4/6抑制剂与化疗联合治疗特定生物标志物驱动的患者群体的疗效和安全性。
因此,鉴于阿贝西利和紫杉醇分别可导致细胞周期G1期阻滞和M期紊乱,可能存在协同效应,研究者开展了一项开放标签的Ib/II期试验,以评估阿贝西利联合紫杉醇治疗CDK4/6通路激活型肿瘤的疗效。此外,研究者还利用治疗前的组织活检样本和ctDNA进行了NGS,以将临床结局与分子和基因组生物标志物相关联,从而确定最有可能从该联合治疗中获益的患者。
研究方法
本研究的 Ib 期(ClinicalTrials.gov:NCT04594005)旨在评估阿贝西利与紫杉醇联合用药的安全性和耐受性,采用标准的 3 + 3 设计,设定起始剂量(剂量水平 1)以及剂量水平 - 1 和 - 2。剂量水平 1 如下:阿贝西利 100 mg,每日两次;紫杉醇 80 mg / m2,在每4周一周期的第 1、8 和 15 天给药。剂量水平 - 1 将紫杉醇剂量降至 70 mg / m2;剂量水平 - 2 将阿贝西利剂量降至 50 mg,每日两次,紫杉醇剂量为 70 mg / m2。在最初的 4 周(第 1 次给药后的 28 天)内评估剂量限制性毒性(DLT),并确定推荐的 II 期剂量(RP2D)(https://doi.org/10.1016/j.esmoop.2024.104106)。
随后,研究进入 II 期,共纳入 30 例患者,其中包括在 Ib 期接受了等于或高于最终 RP2D 剂量的患者。在首次给药后的 16 周内,每 8 周按照 RECIST 1.1 版进行一次肿瘤评估,此后每 12 周评估一次,直至影像学证实疾病进展。治疗持续进行,直至疾病进展、出现无法耐受的毒性或患者撤回知情同意,以先发生者为准。
对于基于组织的肿瘤 NGS 分析,从福尔马林固定石蜡包埋样本中提取基因组 DNA。使用高通量 TruSight Oncology 500 平台(Illumina,美国加利福尼亚州圣地亚哥)进行靶向 DNA 测序。如果患者之前有来自其他平台的肿瘤 NGS 报告,则使用这些报告中的结果。对于ctDNA分析,在基线、第 8 周以及疾病进展后的 28 天内采集血样。对于靶向 panel 测序,构建 DNA NGS 文库,并使用 AlphaLiquid® 100 目标捕获 panel(IMBdx 公司,韩国首尔)进行基于溶液的目标富集,该 panel 包含 118 个癌症相关基因,覆盖整个基因外显子。使用 NextSeq 550Dx 平台(Illumina)对捕获的 DNA 文库进行测序。在这两种分析中,均使用 NGS 报告中确定的具有临床意义的变异。
研究结果
患者:
在2021年2月至2022年4月期间,共有30名患者入组,其中Ib期6名,II期24名。这30名患者中,有27名接受了影像学检查,因此被纳入疗效分析。表1展示了患者的基线临床特征和人口统计学信息。最常见的CDK4/6通路激活突变是CDK4/6扩增(15例患者,占50%)和CCND1/3扩增(6例,占20%)。大多数患者(17例,占56.7%)此前接受过两种或更多种全身性治疗方案。
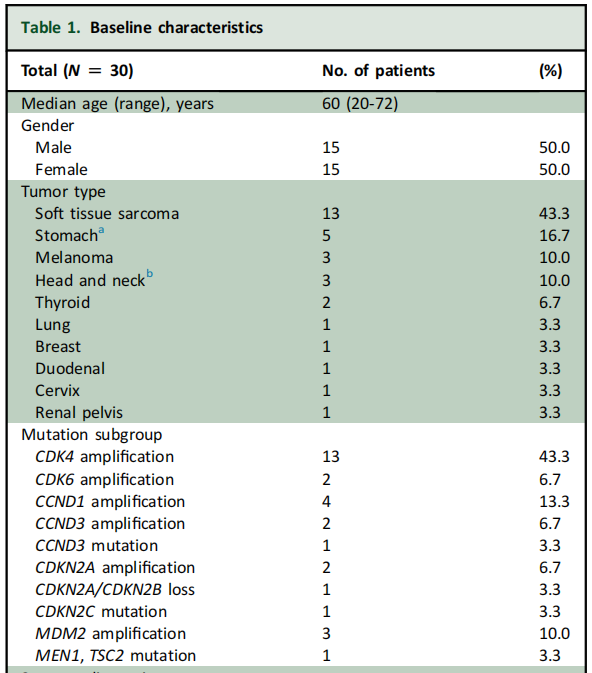
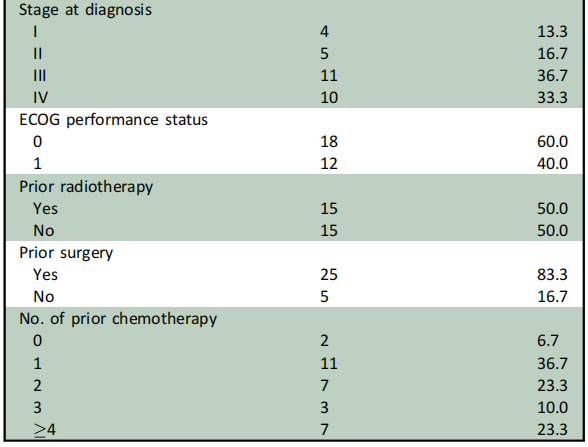
表1
治疗疗效:
在Ib期研究中,剂量水平1组的3名患者中有2名出现了3级和4级中性粒细胞减少症,被判定为剂量限制性毒性(DLT)。随后在剂量水平 - 1组又纳入了3名患者。在该剂量水平下,未出现DLT或意外毒性反应。推荐的RP2D确定为紫杉醇 70 mg/m2,联合阿贝西利100 mg,每日两次。
截至数据截止日期(2023年3月31日),有1名患者仍在继续接受治疗,中位随访时间为15.7个月(95%CI 11.1 - 25.4个月)。在疗效分析集中的27名可评估患者中,有2名(7.4%)达到了PR,16名(59.3%)SD,ORR为7.4%,CBR 66.7%(表2)。中位OS为9.9个月(95%CI 5.7 - 14.0个月),中位PFS为3.5个月(95%CI 2.6 - 4.3个月)(图1A和B)。
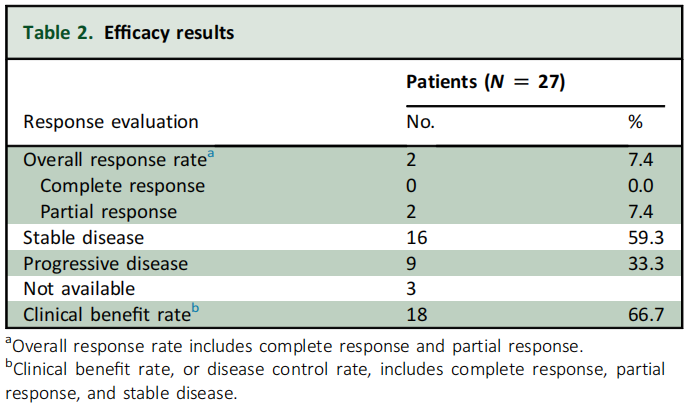
表2
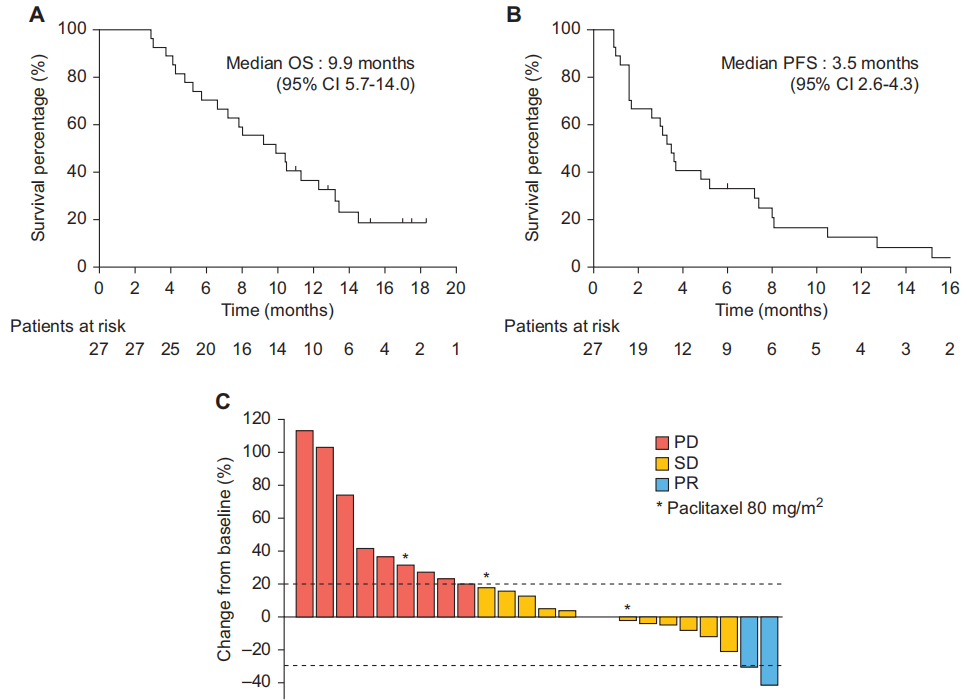
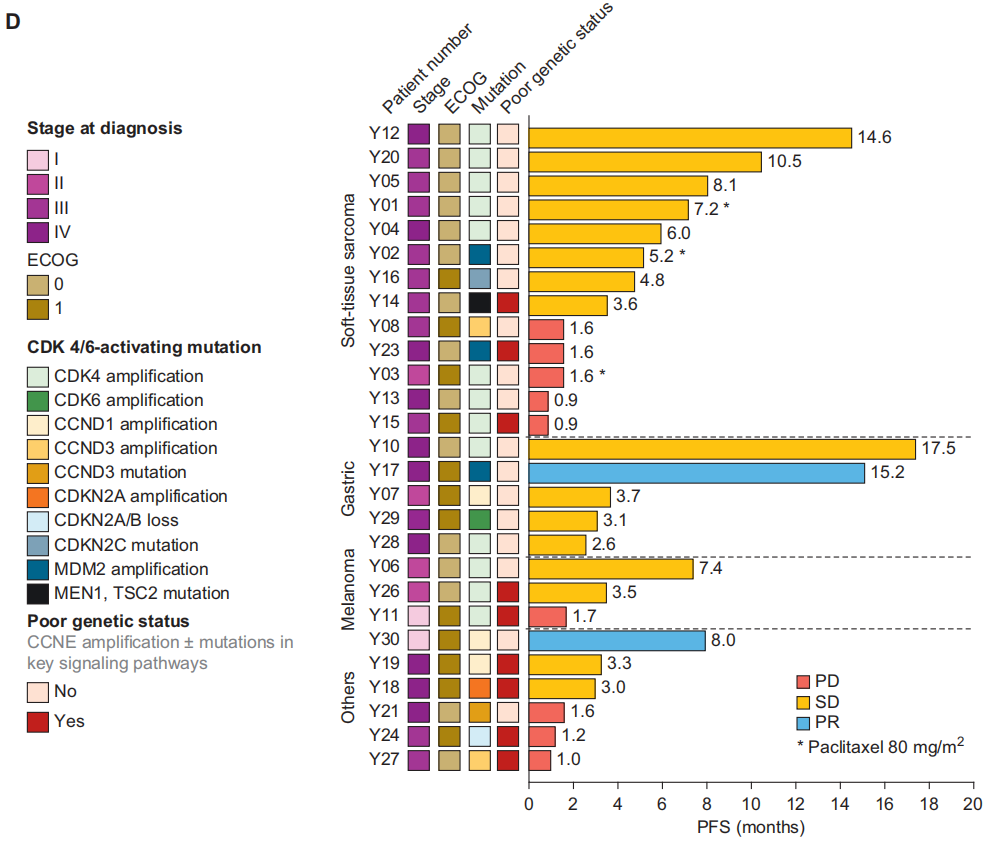

图1
在有可测量靶病灶的患者中,33.3%(8/24)出现了肿瘤缩小,其中1例乳腺癌患者和1例胃癌患者的靶病灶分别缩小了41.6%和30.8%。图1C展示了从基线开始的最佳肿瘤缩小情况。根据肿瘤亚型分组,阿贝西利与紫杉醇联合治疗的效果在图1D中呈现。9例(33.3%)患者出现了较长的PFS(> 6个月),这些患者的肿瘤类型包括软组织肉瘤(STS,5例SD)、胃癌(1例PR、1例SD)、黑色素瘤(1例SD)和乳腺癌(1例PR)。
不良事件与耐受性:
在30例患者中,因各种原因导致9例(30.0%)患者的阿贝西利剂量减至50 mg,1例(3.3%)患者停用阿贝西利。分别有2例(6.7%)、10例(33.3%)和3例(10.0%)患者停用紫杉醇或将剂量减至60 mg或50 mg。阿贝西利的平均(±标准差)剂量强度为79.2%(±37.2%),紫杉醇的平均(±标准差)剂量强度为76.1%(±22.5%)。
血液学毒性是最常见的不良事件(AEs),19例(63.3%)患者出现贫血,其次是中性粒细胞减少症(18例,60.0%)、白细胞减少症(9例,30.0%)和血小板减少症(3例,10.0%)。其他非血液学不良事件包括腹泻(36.7%)、肌酐浓度升高(20%)和神经病变(6%)。15例患者(50%,共21起事件)出现了3级或更高级别的治疗相关AEs,主要为血液学AEs(19起)。研究期间未发生与治疗相关的死亡(表3)。
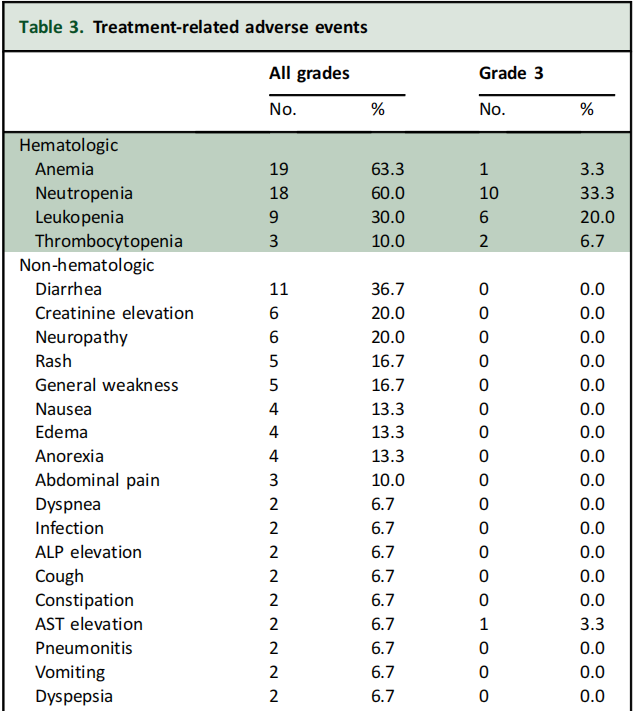
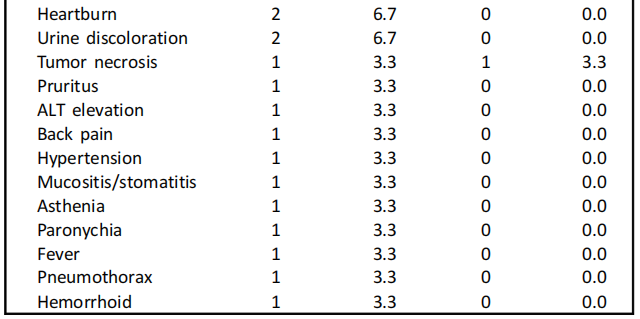
表3
基因组图谱及其与临床疗效的关联:
所有纳入疗效分析的患者都有可用的肿瘤靶向NGS数据(图2A)。最常见的突变基因是TP53(n=9),不过,TP53突变状态与无,PFS并无关联[突变患者的中位PFS为3.3个月(95%CI:3.0个月 - 未达到),野生型患者的中位PFS为3.5个月(95%CI:1.6 - 10.5个月);P = 0.80]。
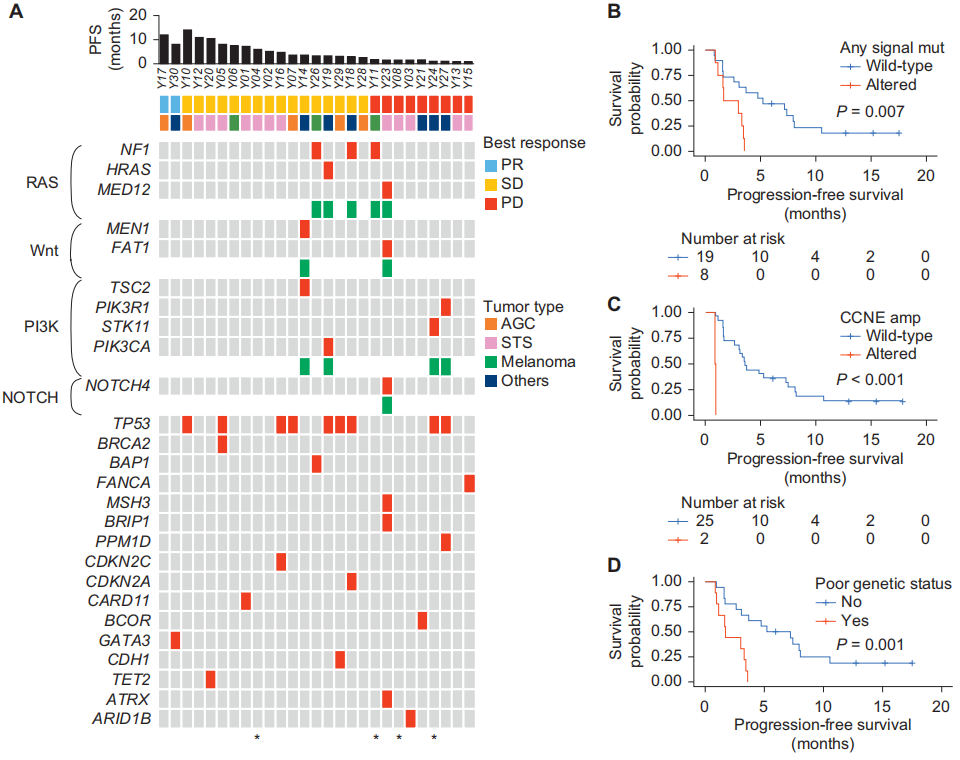
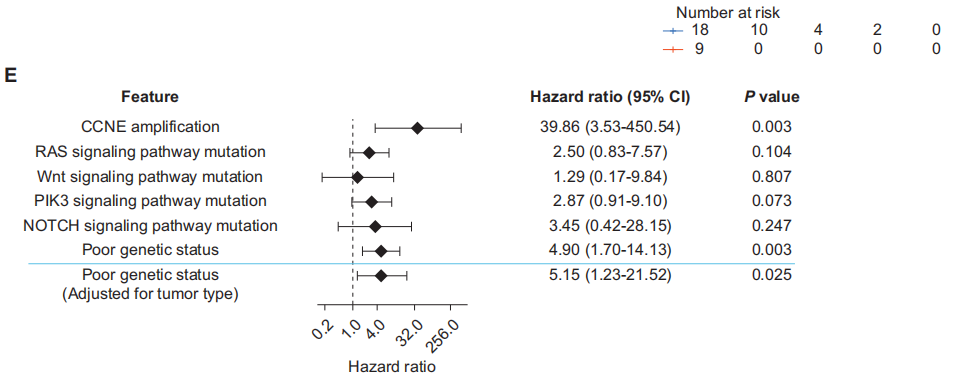

图2
关于与关键信号通路相关的突变(图2A),研究者将多个基因归为特定的信号通路:NF1、HRAS、RASA1和MED12属于RAS信号通路(n = 5);MEN1和FAT1属于Wnt信号通路(n = 2);TSC2、PIK3R1、STK11和PIK3CA属于PI3K信号通路(n = 4);NOTCH4属于NOTCH信号通路(n = 1)。每个信号通路内的突变往往与较差的PFS相关,但无统计学意义。然而,任何这些信号通路中存在突变的患者(n = 8)的PFS显著更差[突变患者的中位PFS为2.4个月(95%CI:1.6个月 - 未达到),无突变患者(n = 19)的中位PFS为5.2个月(95%CI:3.1 - 10.5个月);P = 0.007;图2B]。
对于拷贝数变异,CCNE扩增是影响PFS的一个重要关键因素[CCNE扩增患者(n = 2)的中位PFS为0.9个月(95%CI:0.9个月 - 未达到),无CCNE扩增患者的中位PFS为3.6个月(95%CI:3.0 - 8.0个月);P < 0.001;图2C]。然而,CDK4/MDM2、CDK6、CCND1或CCND3的扩增均未显示出统计学意义。
基于上述发现,研究者将存在旁路信号通路突变和/或CCNE扩增定义为不良基因状态。据此,患者被分为基因状态不良组和基因状态良好组。与基因状态良好组(n = 18)相比,基因状态不良组(n = 9)的PFS显著更差[基因状态不良组中位PFS为1.7个月(95%CI:1.2个月 - 未达到),基因状态良好组为6.2个月(95%CI:3.1个月 - 未达到);P = 0.001;图2D]。在调整肿瘤类型后,这种关联在多变量Cox比例风险模型分析中持续具有统计学意义(图2E)。在本研究中,与其他肿瘤类型相比,STS患者的这些旁路信号通路激活和/或CCNE扩增程度最低。虽然不同肿瘤亚组之间的生存差异无统计学意义,但STS患者呈现出生存期更长的趋势。
探索性ctDNA分析:
疗效分析集中有20例患者可获得基线及随访的ctDNA检测结果(图3A)。值得注意的是,有3例患者在病程中获得了最初不存在的与旁路信号通路相关的突变:GNAQ R183Q(Y13号患者)、TSC2 R611W(Y14号患者)和PIK3CA H1047R(Y18号患者),这些突变均在疾病进展时被检测到(图3B - D)。值得注意的是,试验结束时检测出GNAQ R183Q突变的Y13号患者在基线评估时未表现出不良基因状态。
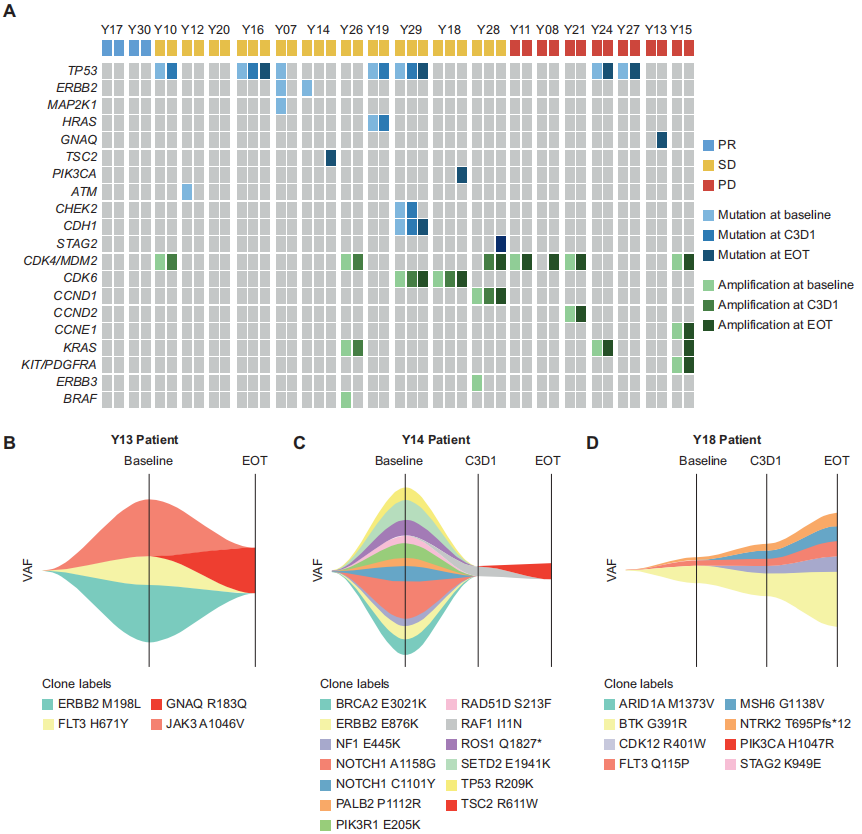

图3
讨 论
在这项Ib/II期试验中,阿贝西利与紫杉醇联合治疗对CDK4/6通路激活的实体瘤显示出66.7%的临床获益率。据研究者所知,这是首次针对携带靶向通路基因变异的肿瘤患者,开展CDK4/6抑制剂与化疗药物联合使用的研究。研究者还通过整合分子分析,评估了临床结局与CDK4/6抑制剂联合治疗之间的关系。
近年来,基因组分析技术的进步推动了基于分子特征的个性化医疗策略研究。有证据表明,CDK4/6抑制剂对激素反应性乳腺癌和去分化脂肪肉瘤(DDLPS)有益。此后,CDK4/6抑制剂作为单药疗法,开始在存在细胞周期基因变异的实体瘤患者中进行评估。在Lung - MAP针对存在细胞周期基因变异的肺鳞癌的子研究中,哌柏西利单药治疗的ORR为6%,疾病控制率为44%。在另一项名为Signature Program的II期不限组织/部位的研究中,针对存在CDK4/6通路变异的肿瘤,瑞波西利单药治疗的ORR为2.9%,PFS为1.8个月。
尽管近期采用了针对特定靶点的治疗方法,但药物疗效仍处于中等水平。因此,基于两种药物的协同作用(阿贝西利可导致细胞周期G1期阻滞,紫杉醇可影响细胞周期M期进程)以及临床前研究结果,本试验旨在评估该联合治疗方案的疗效、安全性及相关生物标志物。尽管跨研究比较存在局限性,但与Signature Program研究(ORR 2.9%;PFS 1.8个月)相比,本研究中观察到的ORR(7.4%)和PFS (3.5个月)更具优势。此外,尽管本研究中的大多数参与者此前接受过大量治疗(56.6%的患者接受过两种或更多种化疗方案),但仍使11例患者(40.7%)获得了持续16周或更长时间的临床获益。
在本研究中,通过调整剂量和给予适当的支持治疗,与治疗相关的毒性反应总体上是可控的。正如多项随机试验所示,研究者采用了低剂量、每周一次的紫杉醇给药方案,以改善患者的预后并提高安全性。因此,本研究中3 - 4级血液学毒性的发生率,包括中性粒细胞减少症(33.3%)、血小板减少症(6.7%)和贫血(3.3%),与哌柏西利单药治疗(分别为50%、30%和17%)或与来曲唑联合治疗(PALOMA试验中分别为54%、2%和6%)的报告结果相当,甚至更低。此外,与阿贝西利联合细胞毒性药物的I期试验相比,本研究中3 - 4级血液学毒性的发生率明显低于阿贝西利联合培美曲塞(中性粒细胞减少症65%;贫血26%;血小板减少症17%)或吉西他滨(中性粒细胞减少症54%;血小板减少症46%;贫血42%)的情况。关于阿贝西利的剂量,在每日两次100 mg、150 mg和200 mg的剂量下,药物浓度 - 时间曲线下从0到24小时的平均稳态面积(AUC0 - 24,ss)和血浆中药物的稳态最大浓度(Cmax,ss)分别稳定维持在约2000 ng∗h/ml 和200 ng/ml以上。在近期一项阿贝西利联合伊立替康和替莫唑胺的I期试验中,使用55 mg/m2的阿贝西利可达到合理且稳定的药物浓度(平均约150 ng/ml)。
鉴于上述证据,尽管这项Ib期研究未纳入药代动力学分析,但它为确定能与细胞毒性化疗有效且安全联用的阿贝西利最佳剂量提供了关键见解。同样,在另一项研究中,与单药治疗时常用的125 mg剂量不同,确定了哌柏西利较低剂量(RP2D:75 mg)与紫杉醇联用的方案。为在控制副作用的同时改善治疗效果,研究者建议未来试验考虑采用每周给药方案。
尽管疗效前景可观,但人们对治疗反应背后的机制了解有限,迫切需要能识别可能从CDK4/6抑制剂治疗中获益的患者的生物标志物。此外,尽管CDK4/6抑制剂是乳腺癌的标准治疗药物,但目前除激素受体阳性外,在使用时并未依据其他标志物进行患者筛选。
很少有研究探讨免疫微环境的预后重要性,以及与细胞周期调控、致癌信号传导、DNA损伤应答/修复缺陷和微环境相关信号传导等多个方面相关的潜在标志物。尽管在乳腺癌随机临床试验中已开展了转化研究,但尚未确立可可靠预测临床结局的标志物。
在本篮子试验中,通过纳入经NGS确定存在CDK4/6信号通路激活的患者,研究者缩小了生物标志物评估的起点。由于细胞周期蛋白E在CDK4/6的下游发挥作用,CCNE扩增成为对CDK4/6抑制剂产生耐药性的一种机制。此外,在对CDK4/6抑制剂耐药的病例中,检测到了在体外会引发耐药的AKT1和RAS家族致癌基因的突变。本研究表明,不良基因状态(存在CCNE扩增和致癌旁路信号通路)的患者可能无法从CDK4/6抑制剂治疗中获益,并强调了进行全面基线基因组特征评估的重要性。这需要可靠的肿瘤NGS分析,可能还ctDNA监测,以便对肿瘤异质性和演变进行更多的空间和时间层面的评估。
本研究存在一些局限性。首先,由于这是一项篮子试验,并非所有肿瘤类型都有同等程度的代表,这可能导致研究人群存在异质性,并引入潜在的偏差。其次,研究的主要目标未达成。然而,有迹象显示肿瘤得到了稳定,尤其是在基因组状态良好的病例中。鉴于大多数CDK4/6抑制剂单药治疗的缓解率较低,在评估CDK4/6抑制剂疗效时,肿瘤稳定情况值得作为一个相关参数来考虑。第三,由于本研究是基于紫杉醇与CDK4/6抑制剂的联合治疗,目前尚不确定所确定的生物标志物是否适用于CDK4/6抑制剂单药治疗。最后,存在突变并不一定能明确证实肿瘤内旁路信号通路被激活。尽管如此,本研究的方法仍然是有效的,因为它有助于识别可能对CDK4/6抑制剂治疗产生良好反应的患者,这有待未来试验进一步证实。
尽管本研究未达到总缓解率ORR这一主要终点,但阿贝西利与紫杉醇的联合治疗所带来的益处与此前报道的CDK4/6抑制剂单药治疗结果相当,且未明显增加毒性。这突显了在检测CDK4/6激活的同时,检测旁路信号通路激活情况的潜在重要性。尽管存在一些局限性,但本研究结果为合理选择治疗方案提供了有价值的参考。这种联合治疗方案需要在更大规模的随机对照试验(涉及与单药治疗进行对比)中进一步研究。
参考文献:
Kim KH, Park C, Beom SH, et al. An open-label, phase IB/II study of abemaciclib with paclitaxel for tumors with CDK4/6 pathway genomic alterations. ESMO Open. Published online January 27, 2025. doi:10.1016/j.esmoop.2024.104106

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#CDK4/6# #阿贝西利#
15