Advanced Science:上海交通大学赵杰/秦安等合作发现骨肉瘤化疗耐药性的潜在新机制
2023-04-02 iNature iNature 发表于上海
化学耐药性是骨肉瘤(OS)治疗的主要障碍,但尚不清楚其发生机制。
化学耐药性是骨肉瘤(OS)治疗的主要障碍,但尚不清楚其发生机制。
2023年3月25日,上海交通大学赵杰、Ma Peixiang、秦安共同通讯在Advanced Science 在线发表题为“DDRGK1 Enhances Osteosarcoma Chemoresistance via Inhibiting KEAP1-Mediated NRF2 Ubiquitination”的研究论文,该研究发现DDRGK结构域蛋白1 (DDRGK1)在OS引发的化疗耐药中起着重要作用。生物信息学和组织分析表明,DDRGK1的高表达与肿瘤晚期和OS临床预后差相关。定量蛋白质组学分析表明,DDRGK1在线粒体氧化磷酸化中起关键作用。DDRGK1敲除触发活性氧(ROS)的积累,并减弱核因子红细胞-2相关因子2(NRF2)的稳定性,NRF1是主要的抗氧化反应元件。
DDRGK2通过与Kelch样ECH相关蛋白1(KEAP1)蛋白的竞争性结合来抑制泛素蛋白酶体介导的NRF2降解,KEAP1蛋白能够将NRF2募集到CULLIN(CUL3)中。DDRGK2敲除会降低NRF2的稳定性,有助于ROS积累,从而促进癌细胞凋亡并增强对阿霉素(DOX)和依托泊苷的化学敏感性。总体来看,DDRGK1敲除显著增强了体内OS对DOX的化疗敏感性。DDRGK1敲除和DOX治疗的结合为OS的有效治疗提供了一个新路径。

骨肉瘤(OS)是最常见的原发性骨肿瘤,在儿童和青少年中发病率较高。OS主要发生在长骨的干骺端,如股骨、胫骨和肱骨,随后侵袭局部组织并进一步发展为全身性转移瘤。OS患者的常用疗法即新辅助治疗,包括手术和术后辅助治疗。自20世纪70年代末以来,大剂量甲氨蝶呤、足叶乙甙或异环磷酰胺联合多柔比星(DOX)或顺铂等化学疗法已显著提高了患者的5年生存率,从不到20%提高到70%以上。然而,由于基因组和个体的异质性,临床分期相似且接受同一类型治疗的患者预后不同。此外,约28%的OS患者在初次诊断时就出现转移,或在化疗和手术后复发,导致截肢或死亡。由于化疗耐药性,过去20年来患者的总生存率并未出现增长。因此,临床上迫切需要开发具有不同作用机制的药物,以有效克服OS中的化疗耐药性。
化疗耐药通过缺氧、内质网(ER)应激和活性氧(ROS)等多种分子机制产生。充分证据表明,ROS是导致化疗耐药的重要因素之一。ROS介导的耐药机制包括氧化还原敏感转录因子的激活、从凋亡向自噬的转换及代谢性重编程等。氧化应激和化疗耐药性之间的关系是相互的,在轻度或慢性ROS刺激下存活的细胞形成化学抗性表型,因此具有化疗耐药性的癌细胞对氧化应激具有抗性。事实上,在化疗耐药肿瘤中经常观察到补偿性的抗氧化活性升高,如能够适应较高ROS浓度的核因子红系-2相关因子2(NRF2)。因此,扰乱不稳定的氧化还原平衡,如消除参与抗氧化防御的酶,将导致细胞死亡,并提供了一个有效策略来克服化疗耐药性。
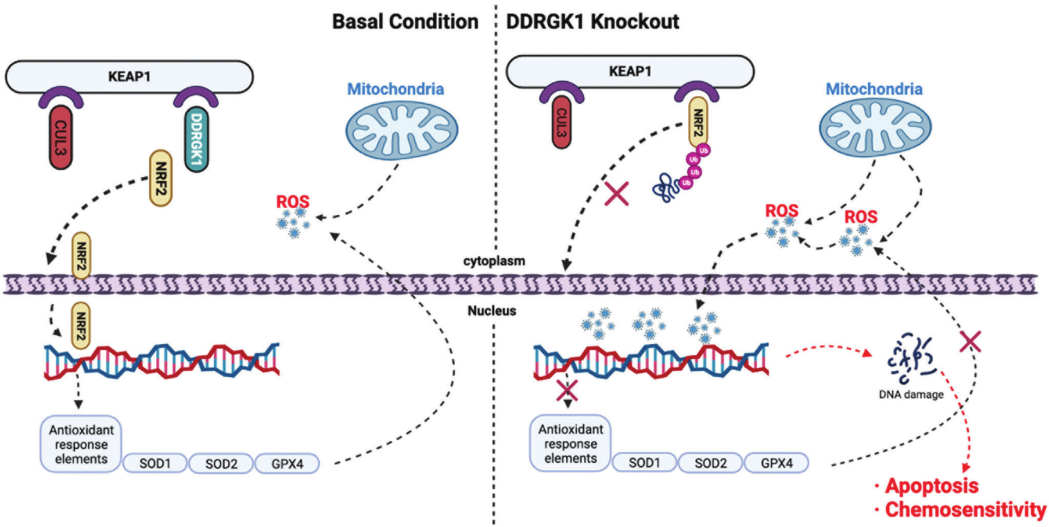
DDRGK1调节NRF2活性的示意图(摘自Advanced Science )
新证据表明,内质网应激和线粒体功能障碍与ROS的产生密切相关。人DDRGK结构域蛋白1(DDRGK1)是一种由20号染色体的短臂(20p13)编码的高度保守蛋白,定位于过氧化物酶体、线粒体,主要位于内质网。已证实DDRGK1通过调节IRE1a的稳定性在内质网稳态中发挥重要作用,这表明了DDRGK1在维持氧化还原稳态中的潜在作用。迄今为止,DDRGK1多被认为是UFMylation的底物,UFMylation将靶蛋白与泛素折叠修饰因子1 (UFM1)结合。尽管最近显示其在UFMylation介导的红细胞发育调节、脊椎前移性胚胎发育不良和浆细胞发育中发挥作用,但DDRGK1调节UFMylation及UFMylation介导的其他功能的机制仍基本未知。事实上,使用无标记定量蛋白质组学对与DDRGK1相互作用蛋白的鉴定结果表明,DDRGK1参与调节蛋白质折叠、稳定性和运输。这一结果说明相比于以往的研究结论,DDRGK1可能发挥着更为重要的作用。
DDRGK1的缺失会导致体内胚胎死亡,表明其在细胞生长中不可或缺的作用,大多数研究认为DDRGK1是一种细胞保护蛋白。就肿瘤生物学而言,尽管其在鳞状细胞癌和肺腺癌等肿瘤中高表达,但很少有证据支持将其视为癌基因。因此,DDRGK1在肿瘤发展中的功能仍有争议。例如,DDRGK1与IκBα相互作用并调节其稳定性,其缺失则会抑制肿瘤细胞增殖。此外,通过与激活信号协同整合子1(ASC1)相互作用,DDRGK1调节ASC1甲基化并加速ER阳性乳腺癌的发展。然而,DDRGK1也显示出通过与UFM1的协同作用和p53的共价修饰,维持p53的稳定性并抑制结肠癌的生长。在没有进一步研究的情况下,很难完全确定DDRGK1在肿瘤中的功能。
由于肿瘤细胞中ROS的上调,其严重依赖抗氧化系统来有效地将ROS保持在致死水平以下,因此破坏其ROS平衡也更容易达到癌症治疗目的。该研究报道了DDRGK1在调节关键ROS蛋白中的新功能,其通过与NRF2竞争结合Kelch样ECH相关蛋白1(KEAP1),阻断CUL3(NRF2的E3连接酶)引发泛素-蛋白酶体介导的降解,从而广泛调节抗氧化系统。研究表明,敲除DDRKG1会诱导细胞内ROS累积,促使细胞凋亡并减弱DOX耐药性,进一步抑制体内肿瘤的形成。总之,上述结果揭示了DDRGK1在KEAP1/NRF2/ROS途径中的关键作用,有助于推动骨肉瘤治疗的研究和化疗耐药性的克服。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202204438
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#DDRGK1#在#Keap1#/#Nrf2#/#ROS#途径中的关键作用,有助于推动#骨肉瘤#治疗的研究和#化疗耐药#性的克服
130